Cho 8gam hỗn hợp X gồm CH4 và C2H4 qua ddich Br2 dư, sau pứ xảy ra hoàn toàn còn lại 3,36l (dktc)
a, Tính thành phần phần trăm theo thể tích mỗi khí trong hỗn hợp X
b, nếu đem đốt cháy hoàn toàn 8 gam hỗn hợp trên rồi dẫn toàn bộ sản phẩm thu được qua dung dịch Ca(OH)2 dư .Tính khối lượng kết tủa thu được sau phản ứng

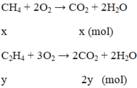
a) Khí còn lại là CH4
\(n_{CH_4} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{C_2H_4} = \dfrac{8-0,15.16}{28} = 0,2(mol)\)
Vậy :
\(\%m_{CH_4} = \dfrac{0,15.16}{8}.100\% = 30\%\\ \%m_{C_2H_4} = 100\% - 30\% = 70\%\)
b)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 2O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CaCO_3} = n_{CO_2} = n_{CH_4} + 2n_{C_2H_4} =0,55(mol)\\ m_{CaCO_3} =0,55.100 = 55(gam) \)