cho 13 gam kẽm vào dung dịch HCl dư được khí thoát ra tính thể khí thu được (dktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,1---->0,1----------------->0,1
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\C_{M\left(HCl\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,25 > 0,1 => CuO dư
Theo pthh: nCu = nH2 = 0,1 (mol)
=> mCu = 0,1.64 = 6,4 (g)
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48l\\
C_M=\dfrac{0,2}{0,2}=1M\\
n_{CuO}=\dfrac{20}{80}=0,25\left(G\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\
LTL:0,25>0,1\)
=>CuO dư
\(n_{Cu}=n_{H_2}=0,1\left(mol\right)\\
m_{Cu}=0,1.64=6,4g\)

nKClO3 = 49 : 122,5 =0,4(mol)
a) pthh : 2KClO3 -t--> 2KCl + 3O2
0,4------------>0,4----->0,6(mol)
mKCl = 0,4.74,5=29,8 (g)
VO2= 0,6.22,4= 13,44 (l)
câu 2
a nZn = 6,5:65=0,1(mol)
pthh : Zn +2HCl ---> ZnCl2 + H2
0,1->0,2----------------->0,1(mol)
=> VH2 = 0,1.22,4 =2,24(l)
=> mHCl = 0,2 . 36,5=7,3 (g)

a.b.c.\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 0,2 ( mol )
\(m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
d.\(n_{CuO}=\dfrac{m}{M}=\dfrac{32}{80}=0,4mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,4 > 0,2 ( mol )
0,2 0,2 0,2 ( mol )
\(m_{chất.rắn}=m_{CuO\left(dư\right)}+m_{Cu}=0,2.80+0,2.64=16+12,8=28,8g\)
\(\%m_{CuO}=\dfrac{16}{28,8}.100=55,55\%\)
\(\%m_{Cu}=100\%-55,55\%=44,45\%\)

\(a,Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol);n_{HCl}=\dfrac{21,9}{36,5}=0,6(mol)\)
Vì \(\dfrac{n_{Zn}}{1}<\dfrac{n_{HCl}}{2}\) nên \(HCl\) dư
\(n_{HCl(dư)}=0,6-0,2.2=0,2(mol)\\ c,n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,2(mol)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2(g)\\ V_{H_2}=0,2.22,4=4,48(l)\)
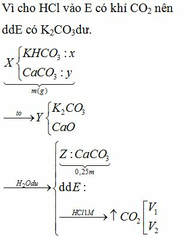
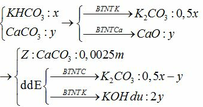
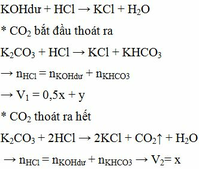
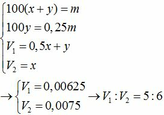

\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2................................0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)