Đốt cháy m gam photpho trong không khí dư, cho toàn bộ sản phẩm cháy vào 500 ml dung dịch H3PO4 85% (D = 1,7g/ml) thì nông độ của axit trong dung dịch tăng thêm 7,6%. Tính khối lượng photpho đã đốt cháy?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Photpho cháy trong không khí lấy dư theo phản ứng :
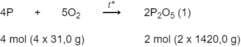
P 2 O 5 tác dụng với tạo thành H 3 P O 4 theo phản ứng :
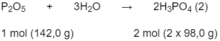
Theo phản ứng (1): 4 x 31,0 g P tạo ra 2 x 142,0 g P 2 O 5
a g P tạo ra 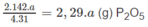
Theo các phản ứng (1) và (2) :
4 x 31,0 (g) P tạo ra 4 x 98,0 (g) H 3 P O 4
a (g) P tạo ra 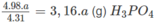
Khối lượng H 3 P O 4 có trong 500,0 ml dung dịch 85,00% :
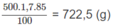
Khối lượng H 3 P O 4 sau khi đã hoà tan P 2 O 5 : 722,5 g + 3,16 x a g.
Khối lượng của dung dịch H 3 P O 4 sau khi đã hoà tan P 2 O 5 :
500,0 x 1,7 g + 2,29 x a g = 850,0 g + 2,29 x a g
Ta có phương trình về nồng độ phần trăm của dung dịch H 3 P O 4 :
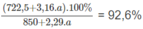
Giải phương trình được a = 62,16 g photpho.

Đáp án : D
2P -> P2O5
=> nP2O5 = 0,075 mol
,nNaOH = 0,6 mol >> nP2O5 => NaOH dư
6NaOH + P2O5 -> 2Na3PO4 + 3H2O
=> Sau phản ứng có : 0,15 mol Na3PO4 và 0,15 mol NaOH
=> mtan = 30,6g

Đáp án D
2P -> P2O5
=> nP2O5 = 0,075 mol
nNaOH = 0,6 mol >> nP2O5 => NaOH dư
6NaOH + P2O5 -> 2Na3PO4 + 3H2O
=> Sau phản ứng có : 0,15 mol Na3PO4 và 0,15 mol NaOH
=> mtan = 30,6g

Đáp án C
2P -> P2O5 -> 2H3PO4
=> nH3PO4 = nP = 0,2 mol
,nOH = 0,5 mol => 2 < nOH : nH3PO4 = 2,5 < 3
Các phản ứng :
2MOH + H3PO4 -> M2HPO4 + 2H2O
3MOH + H3PO4 -> M3PO4 + 3H2O
=> Muối gồm : 0,1 mol M2HPO4 và 0,1 mol M3PO4
=> mmuối = mK + mNa + mHPO4 + mPO4 = 35,4g

Đáp án : C
2P -> P2O5 -> 2H3PO4
=> nH3PO4 = nP = 0,2 mol
,nOH = 0,5 mol => 2 < nOH : nH3PO4 = 2,5 < 3
Các phản ứng :
2MOH + H3PO4 -> M2HPO4 + 2H2O
3MOH + H3PO4 -> M3PO4 + 3H2O
=> Muối gồm : 0,1 mol M2HPO4 và 0,1 mol M3PO4
=> mmuối = mK + mNa + mHPO4 + mPO4 = 35,4g

Đáp án D
nNaOH dư = 0,3(mol); nNaOH dư = nHCl = 0,l(mol)
=> nNaOH phản ứng = naxit = 0,2 (mol)
Gọi công thức chung của các axit là RCOOH
=> Cô cạn D thu được hỗn hợp muối gồm 0,2 mol RCOONa và 0,1 mol NaCl
m R C O O N a = 22 , 89 - 0 , 1 . 58 , 5 = 17 , 04 ( g )
Áp dụng phương pháp tăng giảm khối lượng ta có:
m R C O O N a = m a x i t + 22 n a x i t ⇒ m a x i t = 12 , 64 ( g )
Gọi số mol CO2 và H2O khi đốt cháy A lần lượt là x, y(mol)
Khi hấp thụ sản phẩm cháy vào dung dịch NaOH đặc thì khối lượng bình tăng chính là tổng khối lượng của CO2 và H2O => 44x + 18y = 26,72(g) (1)
Lại có: maxit = mC + mH + mO = 12 n C O 2 + 2 n H 2 O + 16n O trong axit
Vì axit đơn chức => nO trong axit = 2naxit = 0,4(mol)
=> 12,64 = 12x+2y+16.0,4 => 12x+2y = 6,24 (2)
(1) và (2) suy ra x = 0,46(mol); y = 0,36(mol)
Khi đốt cháy A ta thấy
n C O 2 - n H 2 O = n a x i t k h ô n g n o = 0 , 1 ( m o l ) ⇒ n a x i t n o = 0 , 1 ( m o l )
Vì axit không no có ít nhất 3 nguyên tử C trong phân tử
⇒ n C O 2 d o đ ố t c h á y a x i t k h ô n g n o > 0 , 3 ( m o l ) ⇒ n C O 2 d o đ ố t c h á y a x i t n o < 0 , 16 ( m o l )
=> axit không no chỉ có thể là HCOOH
⇒ n C O 2 d o đ ố t c h á y a x i t n o = 0 , 1 ( m o l ) ⇒ n C O 2 d o đ ố t c h á y a x i t k h ô n g n o = 0 , 36 ( m o l )
=> 2 axit không no là C2H3COOH và C3H5COOH.
Gọi số mol của chúng lần lượt là a,b(mol)
⇒ a + b = 0 , 1 3 a + 4 b = 0 , 36 ⇒ a = 0 , 04 b = 0 , 06 V ậ y % m C 2 H 3 C O O H = 0 , 04 . 72 12 , 64
Chú ý: Ta thấy câu này tương tự như câu 9 nhưng điểm khác là hỗn hợp gồm 1 axit no và 2 axit không no; điểm khác thứ hai là bài toán đã cho đốt cháy hỗn hợp axit ban đầu chứ không phải đốt cháy hỗn hợp muối do đó đơn giản hơn và có định hướng giải rõ ràng hơn rất nhiều

Đáp án A
A gồm CnH2nO2 a mol và CmH2m-2O2 b mol với m ≥3
⇒ muối CnH2n-1O2Na a mol và CmH2m-3O2Na b mol
nhh A = nNaOH phản ứng = 0,15 x 2 - 0,1 x 1 ⇒ a + b = 0,2 (1)
Rắn khan gồm: CnH2n-1O2Na a mol, CmH2m-3O2Na b mol và NaCl 0,1 mol
⇒ m chất rắn = a(14n+54) + b(14m+52) + 58,5 x 0,1 = 22,89 ⇒ 14(na+mb) + 2a = 6,64 (2)
Đốt cháy A ⇒ nCO2 = na + mb và nH2O = na + mb - b
Từ: mCO2 + mH2O = 44(na + mb) + 18(na + mb - b) = 26,7 ⇒ 62(na+mb) - 18b = 26,72 (3)
Từ (1), (2) và (3) ⇒ a = b = 0,1 và na + mb = 0,46 ⇒ n + m = 4,6
⇒ n = 1 và m = 3,6 ⇒ axit no HCOOH 0,1 mol hai axit không no là C3H4O2x mol và C4H6O2y mol
Trong đó: x + y = b = 0,1 và số nguyên tử C trung bình = 3,6
Bằng qui tắc đường chéo ⇒ x = 0,04 và y = 0,06
⇒ mA = 46 x 0,1 + 72 x 0,04 + 86x 0,06 = 12,64 gam ⇒ %mC3H4O2 = 22,78%

Đáp án A
Do các axit đơn chức nên ta có: nA = nNaOH pư = nNaOH bđ – nHCl = 0,3 – 0,1 = 0,2 mol
=> nO(A) = 2nA = 0,4 mol
nH2O sinh ra = nNaOH bđ = 0,3 mol
BTKL: mA + mNaOH bđ + nHCl = m chất rắn + mH2O
=> mA + 0,3.40 + 0,1.36,5 = 22,89 + 0,3.18 => mA = 12,64 (g)
Giả sử khi đốt cháy: nCO2 = x mol và nH2O = y mol
BTNT => nC(A) = x mol; nH(A) = 2y mol
+ m bình tăng = mCO2 + mH2O => 44x + 18y = 26,72 (1)
+ mA = mC + mH + mO => 12x + 2y + 0,4.16 = 12,64 (2)
Giải (1) và (2) được x = 0,46 và y = 0,36
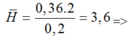 1 axit có 2H (do các axit không no có một nối đôi
1 axit có 2H (do các axit không no có một nối đôi
đơn chức có từ 4H trở đi)
=> A có chứa HCOOH
naxit không no = nCO2 – nH2O = 0,46-0,36 = 0,1 mol
=> nHCOOH = 0,2-0,1 = 0,1 mol
![]()
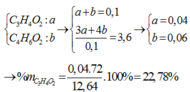
\(4P+ 5O_2 \xrightarrow{t^o} 2P_2O_5\\ P_2O_5 + 3H_2O \to 2H_3PO_4\)
\(n_{P_2O_5} = 0,5n_P = 0,5a(mol)\)
\(n_{H_3PO_4} = n_P = a(mol)\)
\(m_{dung\ dịch} = 500.1,7 = 850(gam)\\ m_{H_3PO_4} = 500.1,7.85\% = 722,5(gam)\\\)
Sau khi thêm sản phẩm cháy vào :
\(m_{H_3PO_4} = 722,5 + 98a(gam)\\ m_{dung\ dịch} = m_{dd\ trước} + m_{P_2O_5} = 850 + 71a(gam)\)
Suy ra :
\(C\%_{H_3PO_4} = \dfrac{722,5+98a}{850+71a}.100\% = 85\% + 7,6\%\\ \Rightarrow a = 2\)
Suy ra: m = 2.31 = 62(gam)
Vì sao nH3PO4=nP
nct là gì