Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi CTTQ của muối halogen là MX
PTHH MX + AgNO3 ----> AgX + MNO3
ta có số mol của MX = số mol của AgX
=> \(\dfrac{4,25}{M+X}\)=\(\dfrac{14,35}{108+X}\) <=> 459+4,25X=14,35M+14,35X
<=> 14,35M+10X=459
+ nếu X là Flo thì M=19(kali)
+ nếu X là Clo thì M=7,24 (loại)
tương tự ta bạn tính ra sẽ loại luôn Brom và Iot
vậy muối halogen đó là KF

Chọn A.
Có m(hh khí) = 6,11; n(hh khí) = 0,13
=> n(Cl2) = 0,05; n(O2) = 0,08.
Hòa tan hết Y trong HCl nên có: n(HCl) = 2.n(H2O) = 2.n(O2-) = 0,32 mol
- BTNT (Cl):
n(Cl- trong Z) = n(AgCl) = n(HCl) + n(Cl-) = 0,32 + 0,1 = 0,42. → m(AgCl) = 0,42.143,5 = 60,27 gam
→ m(kết tủa) = m(AgCl) + m(Ag) → m(Ag) = 73,23 – 60,27 = 12,96 → n(Ag) = 0,12 mol.
=> n(Fe2+) = 0,12.
BTĐT trong Z: 2.0,12 + 2.n(Cu) = 0,42 => n(Cu) = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n(NO) = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n(HNO3) = 4n(NO) = 0,6 mol → m(HNO3) = 37,8 → m(dd HNO3) = 120 gam.
→ BTKL: m(dd T) = m(X) + m(HNO3) – m(NO) = 127,98 gam.
C%(Fe(NO3)3 trong T) = 0,03 . 242 : 127,98 ≈ 5,67%.

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
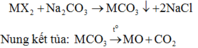
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
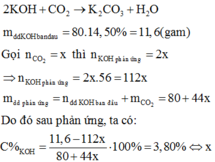 = 0,75
= 0,75

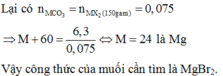

Định làm mà thấy bên dưới có bài y hệt nên thôi nhé
Mà bạn này..Mk thấy mấy bài này kiểu ở lớp 8,9 mà..Sao bạn cứ để ở lớp 10 thế

Chúc bạn học tốt :))

a) Gọi n là hóa trị của M
$2M + nCl_2 \xrightarrow{t^o} 2MCl_n$
Theo PTHH :
n M = n MCln
<=> 11,2/M = 32,5/(M + 35,5n)
<=> M = 56n/3
Với n = 3 thì M = 56(Fe)
Vậy M là Fe
b)
n Cl2 = (32,5 - 11,2)/71 = 0,3(mol)
$2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O$
n HCl = 16/5 n Cl2 = 0,96(mol)
m dd HCl = 0,96.36,5/35,5% = 98,704(gam)

Cái chỗ M đó suy ra là \(M_X< 83,13< M_Y\)
Thì có 2 chất liên tiếp là Br (80) và I (127)

Đáp án C
Hướng dẫn Ta có: ![]()
![]() Cl + AgNO3 →
Cl + AgNO3 → ![]() NO3 + AgCl
NO3 + AgCl
0,13 mol 0,13 mol
=> (![]() + 35,5).0,13 = 6,645 →
+ 35,5).0,13 = 6,645 → ![]() = 15,62
= 15,62
Mà 2 kim loại kiềm thuộc hai chu kì kế tiếp nhau → Li (7) và Na(23)

Cứ 10ml dd X phản ứng với dd AgNO3 dư tạo 0,7175 g kết tủa
\(\Rightarrow\) Với 200ml dd X phản ứng với dd AgNO3 dư tạo \(0,7175\cdot20=14,35\left(g\right)\) kết tủa
PTHH: \(RX+AgNO_3\rightarrow RNO_3+AgX\downarrow\)
Theo phương trình: \(n_{RX}=n_{AgX}\) \(\Rightarrow\dfrac{4,25}{R+X}=\dfrac{14,35}{108+X}\)
Ta thấy với \(\left\{{}\begin{matrix}R=7\\X=35,5\end{matrix}\right.\) thì phương trình trên thỏa mãn
\(\Rightarrow\) Muối cần tìm là LiCl (0,1 mol) \(\Rightarrow C_{M_{LiCl}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
AB + AgNO3 => AgB + ANO3
A+B ----------------108+B
4.25 ---------------- 14.35
->14.35A+10.1B=459
B la Halogen => B = 35.5(cl) => A = 7(li)
B = 80(Br) => A = -68 (loai)
Vay CT mmuoi A la LiCl
Bn giải tắt quá mik cần thật chi tiết