Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

*Lưu ý : Nên vận dụng phương pháp tăng giảm khối lượng để giải nhanh dạng bài này.
Gọi x, y là số mol của NaBr và KI
\(Br_2+2KI\rightarrow2KBr+I2\)
y/2........y.............y..........y/2
hỗn hợp muối sau pứ : 103x+119y=22 (1)
hỗn hợp muối ban đầu : 103x+166y=26.9 (2)
Từ (1),(2) giải hệ tìm được x, y => khối lượng muối của hỗn hợp ban đầu

Gọi n ( Cu) = x ( mol); n ( Mg ) = y ( mol)
Ta có hệ : \(\hept{\begin{cases}m\left(Cu\right)+m\left(Mg\right)=8,8\\m\left(CuCl_2\right)+m\left(MgCl_2\right)=23\end{cases}}\)
<=> \(\hept{\begin{cases}64x+24y=8,8\\\left(64+35,5.2\right)x+\left(24+35,5.2\right)y=23\end{cases}}\)
<=> \(x=y=0,1\)( mol)
=> m ( Cu ) = 0,1 . 64 = 6,4 ( g )
m ( Mg) = 2,4 ( g)
hóa vẫn được à cô . mà cô quên viết phương trình hóa học :))

a) Gọi x,y lần lượt là số mol Fe, Cu trong hhX (x,y>0) (mol)
- Khi cho X t/d hoàn toàn với khí Clo dư:
\(2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ Cu+Cl_2\rightarrow\left(t^o\right)CuCl_2\\ \Rightarrow162,5x+135y=59,5\left(1\right)\)
- Khi cho X tác dụng hoàn toàn với dd HCl 36,5%. Cu sẽ không tác dụng mà chỉ có Fe tham gia phản ứng.
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ m_{FeCl_2}=127x=25,4\left(g\right)\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}162,5x+135y=59,5\\127x=25,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\\ \Rightarrow a=m_{hhX}=m_{Fe}+m_{Cu}=64x+56y=64.0,2+56.0,2=24\left(g\right)\)
Tính phần trăm mỗi muối sau phản ứng chắc ở phản ứng với Clo dư.
\(\%m_{FeCl_3}=\dfrac{0,2.162,5}{0,2.162,5+0,2.135}.100\approx54,622\%\\ \Rightarrow\%m_{CuCl_2}\approx45,378\%\)
b)
\(n_{HCl}=2x=2.0,2=0,4\left(mol\right)\\ \Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\\ \Rightarrow m_{ddHCl}=\dfrac{14,6.100}{36,5}=40\left(g\right)\\ \Rightarrow V_{ddHCl}=\dfrac{m_{ddHCl}}{D_{ddHCl}}=\dfrac{40}{1,25}=32\left(ml\right)=0,032\left(l\right)\)

2Fe + 3 Cl 2 → t ° 2Fe Cl 3 ( M FeCl 3 = 162,5 gam)
Cu + Cl 2 → t ° Cu Cl 2
Fe + 2HCl → Fe Cl 2 + H 2 ( M FeCl 2 = 127 gam)
n Fe = x mol
Theo đề bài và phương trình hóa học trên ta có:
127x = 25,4 => 0,2 mol
162,5x + 135y = 59,5. Thay x = 0,2 vào phương trình, ta có:
32,5 + 135y = 59,5 => y = 0,2
m FeCl 3 = 0,2 x 162,5 = 32,5g
m CuCl 2 = 0,2 x 135 = 27g
% m FeCl 3 = 32,5 : (32,5 + 27).100% = 54,62%
% m CuCl 2 = 100% - 54,62% = 45,38%

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
\(K_2O+H_2O\rightarrow2KOH\)
Theo PT: \(n_K=2n_{H_2}=0,2\left(mol\right)\Rightarrow m_K=0,2.39=7,8\left(g\right)\)
\(\Rightarrow m_{K_2O}=12,4-7,8=4,6\left(g\right)\)

Số mol của 2,24 lít khí H2:
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
\(2Na+2H_2O\rightarrow2NaOH+H_2\uparrow\left(1\right)\)
2 : 2 : 2 : 1
0,1-> 0,1 : 0,1 : 0,05(mol)
\(Na_2O+H_2O\rightarrow2NaOH\left(2\right)\)
Khối lượng của 0,2 mol Na:
\(m_{Na}=n.M=0,2.23=4,6\left(g\right)\)
Do hỗn hợp A gồm Na và H2O nên ta có:
\(m_{Hỗnhợp}=m_{Na}+m_{Na_2O}\\ \Rightarrow m_{Na_2O}=m_{Hỗnhợp}-m_{Na}\\ \Rightarrow m_{Na_2O}=12,4-4,6\\ \Rightarrow m_{Na_2O}=7,8\left(g\right)\)

\(Đặt:n_{MnO_2}=a\left(mol\right),n_{KMnO_4}=b\left(mol\right)\)
\(m_{hh}=87a+158b=37.96\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(n_{Cl_2}=a+2.5b=0.45\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.02\)
\(\%MnO_2=\dfrac{0.4\cdot87}{37.96}\cdot100\%=91.68\%\\\%KMnO_4=100-91.68=8.32\% \)
\(m_M=m_{KCl}+m_{MnCl_2}=0.02\cdot74.5+\left(0.4+0.02\right)\cdot126=54.41g\)

nSO2 = \(\dfrac{2,8}{22,4}\)=0,125 mol
S+6 + 2e → S+4
0,25<-----0,125
=> Số mol e do 3,35 gam hỗn hợp kim loại nhường là 0,25 mol.
Xét phản ứng với Clo
Kim loại + Cl2 → Muối clorua
Có 3,35 gam kim loại phản ứng nên số mol e kim loại nhường cũng là 0,25 mol
Cl20 + 2e → 2Cl-1
0,25 --> 0,25
=> nCl-1 trong muối clorua = 0,25 mol
<=> mCl-1 = 0,25.35,5 = 8,875 gam.
mMuối = mKim loại + mCl-1 = 3,35 + 8,875 = 12,225 gam.

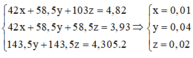
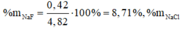
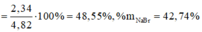
\(\left\{{}\begin{matrix}NaCl:a\left(mol\right)\\KBr:b\left(mol\right)\end{matrix}\right.\)⇒ 58,5a + 119b = 50(1)
2KBr + Cl2 → 2KCl + Br2
b.......................b...................(mol)
Suy ra: 58,5a + 74,5b = 40,1(2)
Từ (1)(2) suy ra \(a = 0,402 ; b = 0,222\\ \Rightarrow m_{NaCl} = 0,402.58,5 = 23,517 ; m_{KBr} = 50 -23,517 = 26,483(gam)\)