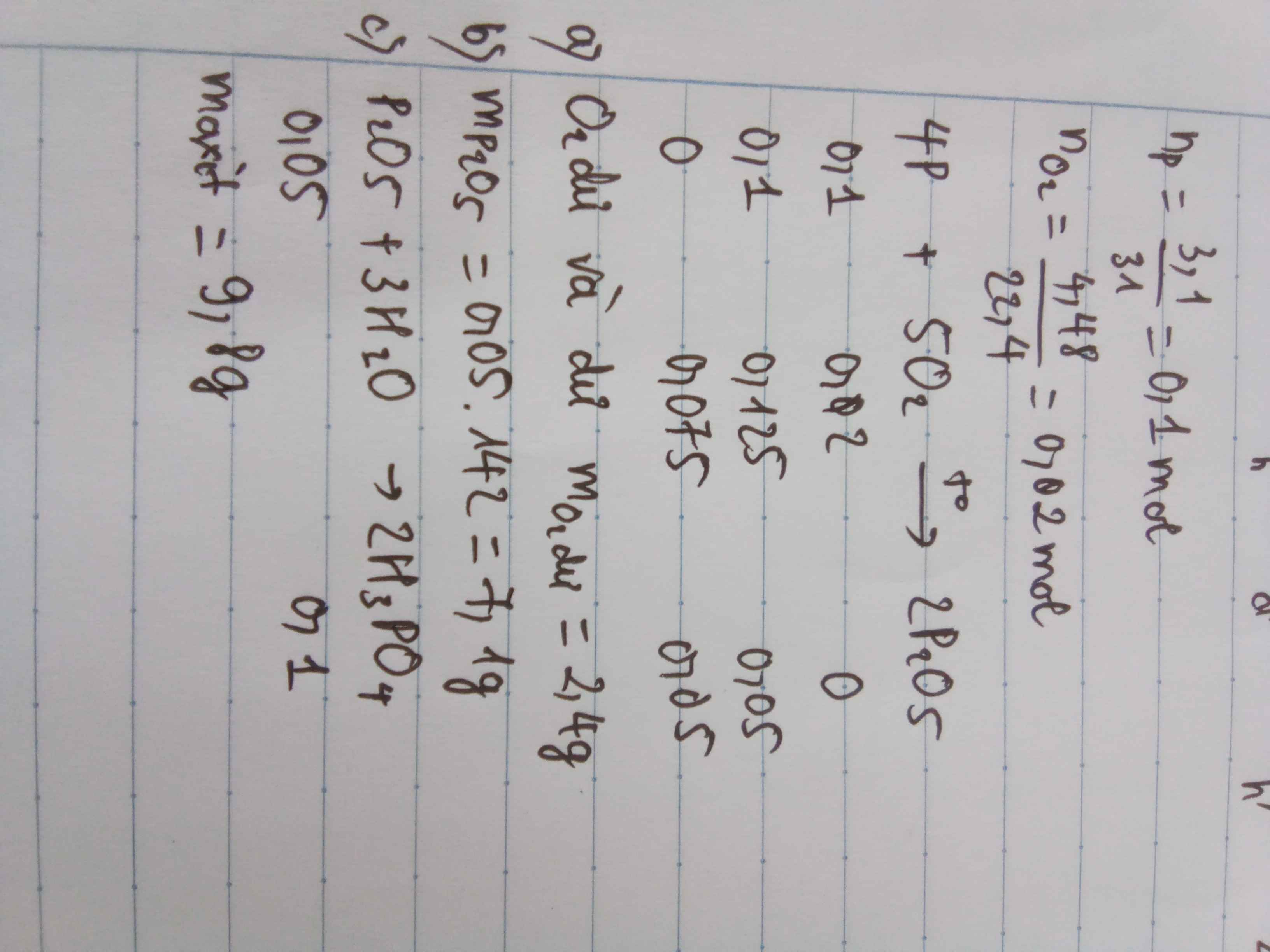đột 1 mẩu photpho trong bình thủy tinh đựng khí oxi dư(đktc),sau phản ứng thu được 1 chất rắn A có màu trắng, đem cân thì thấy nặng 7,1 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
b)
Ta có :
\(n_{P_2O_5} = \dfrac{7,1}{142} = 0,05\ mol\\ \Rightarrow n_P = 2n_{P_2O_5} = 0,05.2 = 0,1(mol)\\ \Rightarrow m_P = 0,1.31 = 3,1(gam)\)
c)
\(n_{O_2} = \dfrac{5}{4} n_P = 0,125(mol)\\ V_{O_2} = 0,125.22,4 = 2,8(lít)\)
Giả sử Oxi chiếm 20% thể tích không khí.
\(V_{không\ khí} = \dfrac{2,8}{20\%} = 14(lít)\)

\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(BTKL:m_{Fe}+m_{O_2}=m_{Fe_3O_4}\)
\(\Leftrightarrow m_{Fe_3O_4}=8.4+\dfrac{4.48}{22.4}\cdot32=14.8\left(g\right)\)
a) \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b)\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Lập tỉ lệ ta có : \(\dfrac{n_{Fe}}{3}< \dfrac{n_{O_2}}{2}\)
=> Sau phản ứng O2 dư, Fe phản ứng hết
Chất rắn sau phản ứng là Fe3O4
\(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,05\left(mol\right)\)
=> mFe3O4=0,05.232=11,6g

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,4}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,15.32=4,8\left(g\right)\)
c, Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(m_{P_2O_5}=14,2.80\%=11,36\left(g\right)\)

Bài 2:
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
PTHH: 4P + 5O2 → 2P2O5
Mol: 0,4 0,2
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
Bài 1:
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,4 0,3
\(V_{O_2}=0,3.22,4=6,72\left(l\right)\)

a) P cháy sáng , có khí trắng bám bình
4P+5O2-to>2P2O5
0,2----0,25------0,1 mol
n P=\(\dfrac{7,44}{31}\)=0,24 mol
n O2=\(\dfrac{8}{32}\)=0,25 mol
P dư :
=>m cr=0,1.142+0,04.31=15,44g
a, Phản ứng sáng chói, P cháy trong O2 tạo ra chất rắn màu trắng dạng bột là P2O5
\(b,n_P=\dfrac{7,44}{31}=0,24\left(mol\right)\\ n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,24}{4}>\dfrac{0,25}{5}\Rightarrow P.dư\\ Theo.pt:n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=\dfrac{2}{5}.0,25=0,1\left(mol\right)\\ m_{P_2O_5}=0,1.142=14,2\left(g\right)\\ Theo.pt:n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=\dfrac{4}{5}.0,25=0,2\left(mol\right)\\ m_{P\left(dư\right)}=\left(0,24-0,2\right).31=1,24\left(g\right)\\ m_X=1,24+14,2=15,44\left(g\right)\)

- Cho phản ứng xảy ra hoàn toàn (2 chất trong A có sắt và oxit khác oxit sắt ban đầu)
\(yH_2+Fe_xO_y\rightarrow\left(t^o\right)xFe+yH_2O\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ n_{H_2\left(2\right)}=n_{Fe\left(2\right)}=n_{Fe\left(1\right)}=0,3\left(mol\right)\\ n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2}=0,4\left(mol\right)\\ BTKL:m_{H_2}+m_{oxit}=m_A+m_{H_2O}\\ \Leftrightarrow0,4.2+m=28,4+18.0,4\\ \Leftrightarrow m=34,8\left(g\right)\\ b,x:y=0,3:0,4=3:4\Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
4P + 5O2 \(\underrightarrow{t^o}\) 2P2O5
\(\dfrac{0,1}{4}< \dfrac{0,2}{5}\) => O2 dư, Photpho đủ
\(n_{O_2}=0,2-0,04=0,16\left(mol\right)\)
\(m_{P_2O_5}=\) 0,05 . 142 = 7,1 ( g )