Câu 1 : Cho 11 gam hỗn hợp X gồm Fe và Al tác dụng hết với lượng dư dung dịch H2SO4 loãng thu được 8,96 lít khí ( ở đktc ) . Tính phần trăm khối lượng mỗi kim loại trong X ?
Câu 2 : Đốt cháy hoàn toàn 1,1 gam este đơn chức X thu được 2,2 gam CO2 và 0,9 gam H2O . Đun 4,4 gam X với dung dịch NaOH dư cho đến khi kết thúc phản ứng , thu được 3,4 gam muối . Xác định các công thức cấu tạo của X ?




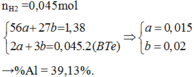
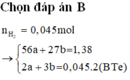
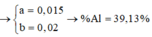
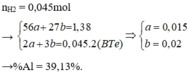
Câu 1:
Giả sử: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 56x + 27y = 11 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Các quá trình:
\(Fe^0\rightarrow Fe^{+2}+2e\)
x___________2x (mol)
\(Al^0\rightarrow Al^{+3}+3e\)
y___________3y (mol)
\(2H^{+1}+2e\rightarrow H_2^0\)
_______0,8__0,4 (mol)
Theo ĐLBT mol e, có: 2x + 3y = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{11}.100\%\approx50,9\%\\\%m_{Al}\approx49,1\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Câu 2 :
\(n_C = n_{CO_2} = \dfrac{2,2}{44} = 0,05(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{0,9}{18} = 0,1(mol)\\ \Rightarrow n_O = \dfrac{1,1-0,05.12-0,1}{16} = 0,025\)
\(n_C : n_H : n_O = 0,05 : 0,1 : 0,025 = 2 : 4 : 1 = 4 : 8 : 2\)(Bắt buộc X phải có 2 nguyên tử oxi vì X là este đơn chức)
Vậy X là C4H8O2.
\(n_X = \dfrac{4,4}{88} = 0,05(mol)\)
Vì X đơn chức nên nmuối = neste = 0,05
\(\Rightarrow M_{muối} = \dfrac{3,4}{0,05} = 68(HCOONa)\)
Vậy CTCT của X là HCOOC3H7