Đốt 2,7g Al trong bình chứa 2,24l \(O_2\)( ở đktc ) thu được bao nhiêu g \(Al_2O_3\), biết phản ứng xảy ra hoàn toàn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: 3Fe + 2O2---nhiệt độ--->Fe3O4
b) Số mol Fe: n = m/M =25,2/ 56 = 0,45 mol
số mol O2 theo PT: 0,45.2/3=0,3 mol
=> thể tích O2 (đktc) = n.22,4=0,3.22,4 = 6,72 lít
c) PTHH: 2KCLO3 ---nhiệt độ---> 2KCL+3O2
Số mol O2: n = V/22,4=6,72/22,4 = 0,3 mol
Số mol KCLO3 theo PT: n = 0,3.2/3 = 0,2 mol
=> khối lượng KCLO3=n.M=0,2.( 39+35,5+16.3)=24,5 gam

a) nFe=0,45mol
PTHH: 2Fe+O2=>2FeO
0,45->0,225
=> VO2 cần dùng =0,225.22,4=5,04 lít
b)2KClO3=>2KCl+3O2
0,15<---------------0,225
=> mKClO3=0,15.122,5=18,375g
A.
Số mol của Fe: n=\(\frac{m}{M}\) =\(\frac{25,2}{56}\) = 0.45 (mol)
2Fe + O2 --t0-> 2FeO
Theo PT 2 : 1 : 2
Theo bài ra 0.45 : 0.225 : 0.45 (mol)
Thể tích Oxi tham gia phảm ứng: V = n . 22,4 = 5.04 ( lít )
B.
Ta có: 2KClO3 -t0-> 2KCl + 3O2
Theo PT 2 : 2 : 3
Theo bài ra 0,15 : 0,15 : 0,225 (mol)
Khối lượng KClO3 : m = n.M = 0.15 . 122,5 = 18,375 (g)

\(a,PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\ n_{Al}=\dfrac{m}{M}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ Theo.PTHH:n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\\ m_{Al_2O_3}=n.M=0,2.102=20,4\left(g\right)\)
\(b,n_{O_2}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Lập.tỉ.lệ:\dfrac{n_{Al}}{4}>\dfrac{n_{O_2}}{3}\Rightarrow Al.dư\\ Theo.PTHH:n_{Al\left(pư\right)}=\dfrac{4}{3}.n_{O_2}=\dfrac{4}{3}.0,2\left(mol\right)\\ n_{Al\left(dư\right)}=n_{Al\left(bđ\right)}-n_{Al\left(pư\right)}=0,4-0,2=0,2\left(mol\right)\\ Theo.PTHH:n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{Al_2O_3}=n.M=0,1=102=10,2\left(g\right)\)

Theo ĐLBT KL, có: mKL + mO2 = m oxit
⇒ mO2 = 28,4 - 15,6 = 12,8 (g)
\(\Rightarrow n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\Rightarrow V_{O_2}=0,4.22,4=8,96\left(l\right)\)
Đốt 64 g Cu trong 6,96 lít oxi ở ĐKTC . Tính khối lượng oxit thu được biết phản ứng xảy ra hoàn toàn

\(n_{Cu}=\dfrac{64}{64}=1\left(mol\right)\)
PTHH :
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
trc p/u: 1 87/280
p/u 87/140 87/280 87/140
sau : 53/140 0 87/140
--> sau p/ư : Cu dư
\(m_{CuO}=\dfrac{87}{140}.80\approx49,7\left(g\right)\)
Bạn kiểm tra lại số lít khí Oxi nha

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,225\left(mol\right)\Rightarrow V_{O_2}=0,225.22,4=5,04\left(l\right)\)
c, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,15\left(mol\right)\Rightarrow m_{KClO_3}=0,15.122,5=18,375\left(g\right)\)

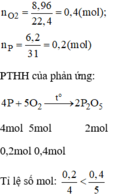
→ Oxi dư, vậy bài toán tính theo số mol của P
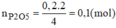
Do H = 80% nên khối lượng chất rắn thu được sau phản ứng là:
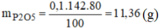
Ta có :
\(n_{Al} = \dfrac{2,7}{27} = 0,1(mol)\\ n_{O_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\)
Ta thấy : \(\dfrac{n_{Al}}{4} = 0,025 < \dfrac{n_{O_2}}{3} =0,03\) nên O2 dư.
\(n_{Al_2O_3} = 0,5n_{Al} = 0,05(mol)\\ \Rightarrow m_{Al_2O_3} = 0,05.102 = 5,1(gam)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(n_{O_2\left(đktc\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: \(4Al+3O_2\rightarrow2Al_2O_3\)
Ta có tỉ lệ: \(\dfrac{0,1}{4}< \dfrac{0,1}{3}\)
-> \(O_2\) sẽ dư sau phản ứng.
Theo pthh: \(n_{Al_2O_3}=\dfrac{2}{4}n_{Al}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
-> \(m_{Al_2O_3}=0,05.102=5,1\left(g\right)\)