36,0 gam hỗn hợp X gồm 2 kim loại (đều ở nhóm IIA, 2 chu kì liên tiếp) phản ứng hết với dung dịch H2SO4 loãng, sinh ra 22,4 lít khí H2 (đktc). Hai kim loại là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Gọi công thức chung của hai kim loại thuộc nhóm IIA là M .
Có phản ứng:
![]()
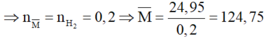
Do đó hỗn hợp cần có 1 kim loại có M < 124,75 và 1 kim loại có khối lượng mol lớn hơn 124,75.
Mà hai kim loại trong hỗn hợp ở hai chu kì liên tiếp và thuộc nhóm IIA.
Nên hai kim loại đó là Se và Ba.
Chú ý: Khi cho hỗn hợp hai kim loại có cùng hóa trị thì ta thường sử dụng công thức trung bình của hai kim loại.

Đáp án B
Gọi công thức chung của hai kim loại thuộc nhóm IIA là M
Có phản ứng:
![]()
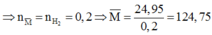
Do đó hỗn hợp cần có 1 kim loại có M < 124,75 và 1 kim loại có khối lượng mol lớn hơn 124,75.
Mà hai kim loại trong hỗn hợp ở hai chu kì liên tiếp và thuộc nhóm IIA.
Nên hai kim loại đó là Se và Ba.
Chú ý: Khi cho hỗn hợp hai kim loại có cùng hóa trị thì ta thường sử dụng công thức trung bình của hai kim loại.

Đáp án A
Hướng dẫn Thay thế hỗn hợp kim loại bằng một kim loại tương đương ![]()
Số mol H2 = 0,09 (mol)
![]() + H2SO4 →
+ H2SO4 → ![]() SO4 + H2
SO4 + H2
(mol) 0,09 ![]() 0,09
0,09
![]()
=> Mg =24< 29,33 < 40=Ca
X, Y là Mg, Ca






Gọi công thức của hai kim loại cần tìm là A và B
công thức trung bình của hai kim loại là \(\overline{R}\)
PTHH : \(\overline{R}+H_2SO_4-->\overline{R}SO_4+H_2\uparrow\)
Theo PTHH : \(n_{\overline{R}}=n_{H_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\)
\(\Rightarrow M_{\overline{R}}=\dfrac{36}{1}=36\) (g/mol)
Có : \(M_A< M_R=36< M_B\)
Mà : A và B thuộc hai chu kì liên tiếp
=> \(\left\{{}\begin{matrix}A:Mg\\B:Ca\end{matrix}\right.\)
Vậy ...