Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2NaCl +2H2O→2NaOH+H2↑+Cl2↑
H%=80=\(\frac{2n_{Cl_2}}{n_{Nacl}}\) →mCLo

TK
a) Phương trình hóa học: Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
b) Số mol NaOH điều chế được: nNaOH = 2nNa2CO3 =0,25. 2 = 0,5 mol

Giải thích: Đáp án A
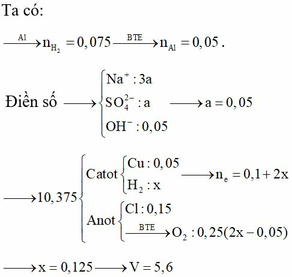
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al + OH-→AlO2-+ 1,5H2
=>nOH-=nH2/1,5=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm= 64a + 71a + 71.0,5a + 2.0,5a = 8,575 gam < 10,375
=> H2O bị điện phân: mH2O= 10,375-8,575 = 1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne= 0,075.2 + 0,05.4 = 0,35 mol=> t = ne.96500/I=0,35.96500/1,34=25205,2 giây = 7 giờ.
Chú ý: H2O bị điện phân






2NaCl + 2H2O điện phân dd có màng ngăn --> 2NaOH + Cl2 + H2
nCl2 =\(\dfrac{8,96}{22,4}\)= 0,4 mol . Hiệu suất phản ứng = 80% => nNaCl = \(\dfrac{0,4.2}{80\%}\)=1 mol
=> mNaCl = 1.58,5 = 58,5 gam