Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \Rightarrow n_{Fe}=0,1\left(mol\right)\\ \Rightarrow m_{Fe}=0,1\cdot56=5,6\left(g\right)\\ \Rightarrow\%_{Fe}=\dfrac{5,6}{12}\cdot100\%\approx46,67\%\\ \Rightarrow\%_{Cu}\approx100\%-46,67\%=53,33\%\)
Bài 2:
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ \Rightarrow n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,2\cdot22,4=4,48\left(l\right)\)

n H2=\(\dfrac{8,96}{22,4}\)=0,4 mol
2Al + 6HCl→2AlCl3 + 3H2 (1)
x----------------------------3\2x
Zn +2 HCl→ZnCl2 + H2 (2)
y----------------------------y mol
ta có hệ :
27x+65y=11,9
\(\dfrac{3}{2}\)x+y=0,4
=>x=0,2 mol->m Al=0,2.27=5,4g
=>y=0,1 mol->m Zn=0,1.65=6,5g
nắm chắc pthh là xong hết , về luyện là đc
\(nH_2=8,96:22,4=0,4mol\)
PTHH:
\(2Al+2Zn+2HCl\rightarrow2AlZnCl+H_2\)
0,8<--0,8<----0,8<------<0,8--------<0,4
\(mAl=0,8.27=21,6gam\)
\(mZn=0,8.65=52gam\)
\(mAlZnCl=102gam\)

Đáp án B
Số mol H2 thu được là: n H 2 = 0 , 3 mol
Đặt số mol các chất trong X là Zn: a mol ; Fe: b mol.
m Zn + m Fe = m X ⇒ 65 a + 56 b = 18 , 6 ( I )
Sơ đồ phản ứng:
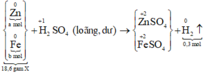
Các quá trình nhường, nhận electron:
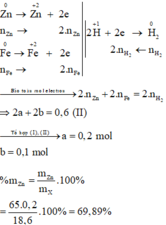

200ml dung dịch H2SO4 loãng.
a) Cu không phản ứng với H2SO4 loãng.
Zn + H2SO4 --> ZnSO4 + H2
b) nH2 = \(\dfrac{1,12}{22,4}\)=0,05 mol => nZn = 0,05 mol
mZn = 0,05.65 = 3,25 gam <=> mCu = 8,5 - 3,25 = 5,25 gam
Chất rắn thu được sau phản ứng chính là Cu không phản ứng = 5,25 gam.
c)
nH2SO4 = nH2 = 0,05 mol
=> CH2SO4 = \(\dfrac{n}{V}\)= \(\dfrac{0,05}{0,2}\)= 0,25 M

a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
Theo PTHH : $n_{Zn} = n_{H_2} = \dfrac{2,8}{22,4} = 0,125(mol)$
$m_{Zn} = 0,125.65 = 8,125(gam)$
$m_{Cu} = 8,3 - 8,125 = 0,175(gam)$
$\%m_{Zn} = \dfrac{8,125}{8,3}.100\% = 97,9\%$
$\%m_{Cu} = 100\% -97,9\% = 2,1\%$
$n_{H_2SO_4} = n_{H_2} = 0,125(mol) \Rightarrow m_{H_2SO_4} = 0,125.98 = 12,25(gam)$
PTHH : Zn +HCl →ZnCl2 + H2
Theo bài ra : số mol của H2 =0,15 (MOL)
Theo pt ⇒ nZn=nH2=0,15( mol)
⇒mZn=9,75⇒mCu=21-9,75=11,25(g)
%Zn=9,75/21.100%=46,43%
%Fe=100%-46,43%=53.57%
câu a