Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

m dd A = 4 . 79,3 = 317,2g
Qui đổi hỗn hợp FeO, Fe2O3, Fe3O4về Fe3O4 có số mol là a
Ta có 232a + (a . 4 . 1,5 . 98) : 0,2 = 317,2
=> a = 0,1 mol
Dd ban đầu
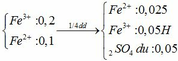
Phần 1:
8H2SO4 + 2KMnO4 + 10FeSO4 → 5Fe2(SO4)3 + 8H2O + 2MnSO4 + K2SO4
0,05 0,025
=> FeSO4 phản ứng hết
=> nKMnO4 = 0,005mol
=> V1= 0,1 lít = 100ml
Phần 2:
2Fe2+ + Br2 → 2Fe3+ + 2Br-
0,025 0,0125
=> V2 = 0,25 lít = 250ml
Phần 3:
2Fe3+ + 2I- → 2Fe2+ + I2
0,05 0,05
=> V3 = 1 lít = 1000ml
Phần 4:
Fe2+ + CO32- → FeCO3↓
0,025 0,025 0,025
2Fe3+ + 3CO32- + 3H2O → 2Fe(OH)3 + 3CO2
0,05 0,075 0,05 0,075
2H+ + CO32- →CO2 + H2O
0,1 0,05 0,05
=> nCO2 = 0,125
=> V4 = 2,8 lít
m kết tủa = mFeCO3 + mFe(OH)3 = 8,25g

Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_M=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần) ⇒ 56x + MM.y = 5,56:2 (1)
Giả sử M có hóa trị n không đổi.
- Phần 2: \(n_{Cl_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(2M+nCl_2\underrightarrow{t^o}2MCl_n\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}+\dfrac{n}{2}n_M=\dfrac{3}{2}x+\dfrac{n}{2}y=0,09\left(2\right)\)
- Phần 1: \(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
+ TH1: M có pư với HCl.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Theo PT: \(n_{H_2}=n_{Fe}+\dfrac{n}{2}n_M=x+\dfrac{n}{2}y=0,07\left(3\right)\)
Từ (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\ny=0,06\end{matrix}\right.\)
Thay vào (1), ta được: \(M_M.y=0,54\) \(\Rightarrow\dfrac{M_M.y}{n.y}=\dfrac{0,54}{0,06}\Rightarrow M_M=9n\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
→ M là Al.
+ TH2: M không pư với HCl.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(x=n_{Fe}=n_{H_2}=0,07\left(mol\right)\)
Thay vào (1) ta được \(M_M.y=-1,14\) (vô lý vì MM và y đều là số dương)
Vậy: M là Al.

Gọi phần trăm số nguyên tử của C 17 35 l là x, C 17 37 l là (100 – x).
Cl2 + H2 ® 2HCl (1)

M ¯ C l = 35 x + 37 ( 100 − x ) 100 ⇒ x = 75
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : C 17 35 l (75% ) ; C 17 37 l (25%).
ĐÁP ÁN A

PTHH:
\(M+H_2SO_4\rightarrow M_2\left(SO_4\right)_x+H_2\left(1\right)\)
\(M+O_2\rightarrow M_2O_x\left(2\right)\)
Phần 1:
\(n_{SO_4}=n_{H_2SO_4}=n_{H_2}=0,2\left(mol\right)\)
Ta có: \(m_{M_2\left(SO_4\right)_x}=m_M+m_{SO_4}\Leftrightarrow m_1=\dfrac{m}{2}+0,2.96=\dfrac{m}{2}+19,2\left(3\right)\)
Phần 2:
Ta có: \(m_O=m_{M_2O_x}-m_M=m_2-\dfrac{m}{2}\Rightarrow n_O=\dfrac{m_2}{16}-\dfrac{m}{32}\left(mol\right)\)
Lại có: \(n_{SO_4\left(1\right)}=x.n_{M_2\left(SO_4\right)_n}=\dfrac{x}{2}.n_M=x.n_{M_2O_x}=n_{O\left(2\right)}\)
\(\Leftrightarrow0,2=\dfrac{m_2}{16}-\dfrac{m}{32}\)
\(\Leftrightarrow3,2=m_2-\dfrac{m}{2}\)
\(\Leftrightarrow m_2=\dfrac{m}{2}+3,2\left(4\right)\)
Từ \(\left(3\right)\) và \(\left(4\right)\Rightarrow m_1-m_2=16\)

Ta có: m dd HCl (1) = 1,047.150 = 157,05 (g)
\(\Rightarrow m_{HCl\left(1\right)}=157,05.10\%=15,705\left(g\right)\Rightarrow n_{HCl\left(2\right)}=\dfrac{15,705}{36,5}=0,43\left(mol\right)\)
\(n_{HCl\left(2\right)}=0,25.2=0,5\left(mol\right)\)
\(\Rightarrow C_{M_A}=\dfrac{0,43+0,5}{0,15+0,25}=2,325M\)
Giả sử: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 65x + 56y = 2,7 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Có: \(n_{HCl}=0,04.2,325=0,093\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}+2n_{Fe}=2x+2y\left(mol\right)\)
\(\Rightarrow2x+2y=0,093\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{4}{375}\left(mol\right)\\y=\dfrac{43}{1200}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{\dfrac{4}{375}.65}{2,7}.100\%\approx25,68\%\\\%m_{Fe}\approx74,32\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án D
Gọi phần trăm số nguyên tử của X 17 35 là x, X 17 37 là (100 – x).
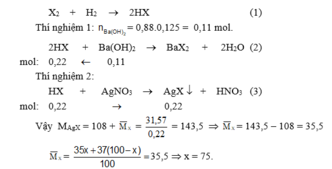
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : C 17 35 l (75% ) ; C 17 37 l (25%).

