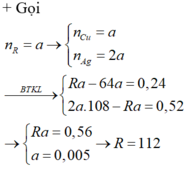Nung nóng kim loại M trong O2 dư thì thấy khối lượng chất rắn thu được tăng 25% so với ban đầu. Tìm kim loại R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


CuO+H2to→Cu+H2O
Theo PT: nCuO=nCu(1)
Ta có mrắngiảm=mCuO−mCu=3,2(g)
→80nCuO−64nCu=3,2(2)
Từ (1)(2)→nCuO=nCu=\(\dfrac{3,2}{80-64}\)=0,2(mol)(1)(2)
→nCuO=nCu=3,280−64=0,2(mol)
Theo PT: nH2=nCu=0,2(mol)
Đặt hóa trị R là n(n>0)
2R+2nHCl→2RCln+nH2
Theo PT: nR.n=2nH2
→\(\dfrac{13n}{MR}\)=0,4
→MR=32,5n
Với n=2→MR=65(g/mol)
→R là kẽm (Zn)

a)
Gọi số mol R là a (mol)
PTHH: 2R + nH2SO4 --> R2(SO4)n + nH2
a------------------------->0,5an
mtăng = mR - mH2 = a.MR - 2.0,5an = a.MR - an = 1,2 (1)
PTHH: 4R + nO2 --to--> 2R2On
a--------------->0,5a
=> \(0,5a\left(2.M_R+16n\right)=2,55\)
=> a.MR + 8an = 2,55 (2)
(1)(2) => a.MR = 1,35; an = 0,15
=> \(M_R=9n\left(g/mol\right)\)
Xét n = 3 thỏa mãn => MR = 27 (g/mol)
=> R là Al
a = 0,05 (mol)
m = 1,35 (g)
b)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
=> VO2 = 0,0375.22,4 = 0,84 (l)
=> Vkk = 0,84 : 20% = 4,2 (l)

Đặt nZn = x mol; nFe = y mol.
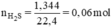
Ta có hệ phương trình: 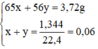
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Đáp án D
Đặt số mol Fe và C trong hợp kim lần lượt là x và y.
Vậy m = 56x + 12y
Phản ứng xảy ra khi nung hợp kim này trong không khí:


Đáp án A
Nếu Mg còn dư trong phản ứng
=> mthanh hợp kim tăng = (64-24).0,075=3g > 1,16 g
=> Chứng tỏ Mg phản ứng hết.
Đặt số mol Mg và Fe phản ứng lần lượt là x, y.
=> mthanh hợp kim tăng =x(64-24)+y(64-56)=1,16g
Có ![]()
=> NaOH phản ứng với Y còn dư => 5 gam chất rắn gồm MgO, Fe2O3, có thể có CuO
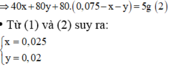
Đặt số mol Al và Fe còn dư lần lượt là a, b
=> mthanh hợp kim = 108a+24.0,025+56.(0,02+b)=8,8g
→ BTe a + 3 b + 2 . ( 0 , 025 + 0 , 02 ) = 2 . n S O 2 = 2 . 2 , 576 22 , 4 = 0 , 23 m o l


\(PT:Fe+Cu3O_4\rightarrow FeSO_4+Cu\)
\(m\uparrow=-mFe+mCu=4\left(g\right)\)
\(nFe=\dfrac{4}{-56+64}=0,5\left(mol\right)\)
\(\Rightarrow mFe=28\left(g\right)\Rightarrow mCu=72\)