Một hỗn hợp X gồm Ba và Al. Cho m gam X tác dụng với nước dư; thu được 2,688 lít khí (đktc). Cũng m gam X trên cho tác dụng với dung dịch Ba(OH)2dư thu được 3,696 lít khí (đktc). Giá trị m là
![]()
![]()
![]()
![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


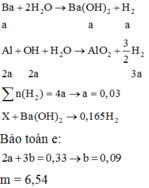

Đáp án C
3m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 3,9 mol khí
=> m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 1,3 lít khí
Gọi x = nBa
Ba + 2H2O → Ba(OH)2 + H2 (1)
x → x → x
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 (2)
2x ← x → 3x
Al còn dư → 3 2 H2
Do tác dụng với nước chỉ thu được 1 mol H2 mà tác dụng với dung dịch Ba(OH)2 dư lại tạo ra 1,3 mol H2 nên sau khi cho hỗn hợp X tác dụng với H2O thì Al vẫn còn dư tạo ra thêm 0,3 mol H2
Al còn dư → 3 2 H2
0,2 mol ← 0,3 mol
Ta có nH2 = x + 3x = 1=> x = 0,25
=> m = mBa + mAl pư + mAl còn dư = 137.x + 27.2x + 27.0,2 = 53,15g

3m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 3,9 mol khí
⇒ m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 1,3 lít khí
Gọi x = nBa
Ba + 2H2O → Ba(OH)2 + H2 (1)
x → x → x
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 (2)
2x ← x → 3x
Al còn dư → 3 2 H2
Do tác dụng với nước chỉ thu được 1 mol H2 mà tác dụng với dung dịch Ba(OH)2 dư lại tạo ra 1,3 mol H2 nên sau khi cho hỗn hợp X tác dụng với H2O thì Al vẫn còn dư tạo ra thêm 0,3 mol H2
Al còn dư → 3 2 H2
0,2 mol ← 0,3 mol
Ta có nH2 = x + 3x = 1 ⇒ x = 0,25
⇒ m = mBa + mAl pư + mAl còn dư = 137.x + 27.2x + 27.0,2 = 53,15g ⇒ Chọn C.

Đáp án C
• m gam X + nước → V lít H2 + 0,182m gam Al dư.
2Na + 2H2O → 2NaOH + H2
x x 0,5x mol
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2
x → x l,5x
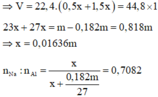
• 0,3075 mol X + NaOH dư → 0,982V lít H2.
2Na + 2H2O → 2NaOH + H2
y y 0,5y mol
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2
z → l,5z
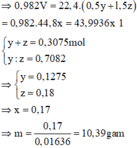

Đáp án C
Các phản ứng xảy ra:
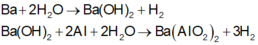
Khi cho m gam X tác dụng với dung dịch Ba (OH)2 dư thu được 20,832/2=10,416 lít H2 (đktc)
Vì thể tích H2 thu được ở hai trường hợp (khi sử dụng cùng khối lượng hỗn hợp X) khác nhau nên khi hòa tan hỗn hợp vào nước thì còn một phần kim loại Al dư không tan.
Trong m gam X gọi n Ba = a n Al = b
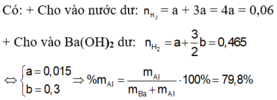

a)
Gọi $n_{Al} = a(mol); n_{Fe} = b(mol)$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 1,5a = \dfrac{9,6}{32} = 0,3 \Rightarrow a = 0,2(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = 1,5a + b = 0,4 \Rightarrow b = 0,1(mol)$
$\Rightarrow m = 0,2.27 + 0,1.56 = 11(gam)$
b)
$AlCl_3 + 3NaOH \to Al(OH)_3 + 3NaCl$
$Al(OH)_3 + NaOH \to NaAlO_2 + 2H_2O$
$FeCl_2 + 2NaOH \to Fe(OH)_2 + 2NaCl$
$n_{Fe(OH)_2} = n_{Fe} = 0,1(mol)$
$m_{Fe(OH)_2} = 0,1.90 = 9(gam)$

Al không tác dụng với $HNO_3$ đặc nguội
$Cu + 4HNO_3 \to Cu(NO_3)_2 + 2NO_2 + 2H_2O$
$n_{Cu} = \dfrac{1}{2}n_{NO_2} = \dfrac{1}{2}.\dfrac{3,36}{22,4} = 0,075(mol)$
Mặt khác : $n_{NO} = \dfrac{7,84}{22,4} = 0,35(mol)$
Bảo toàn electron : $2n_{Cu} + 3n_{Al} = 3n_{NO}$
$\Rightarrow n_{Al} = \dfrac{0,35.3 - 0,075.2}{3} = 0,3(mol)$
$m = 0,075.64 + 0,3.27 = 12,9(gam)$

Lần trước em đăng đề thiếu nên mới không làm được nhé em !
a) Đặt x, y lần lượt là số mol Ba,Al trong hỗn hợp A
Cho m gam A + H2O dư
=> Phần không tan C là Al dư
Ba + 2H2O → Ba(OH)2 + H2
x--------------------->x-------->x
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
2x<-----x---------------------------->x----------->3x
=>\(n_{H_2}=x+3x=\dfrac{1,344}{22,4}=0,06\) (1)
Cho 2m gam A + Ba(OH)2 dư
=> Số mol Ba,Al lần lượt là 2x; 2y
Vì kiềm dư nên cả 2 kim loại đều tan hết
Ba + 2H2O → Ba(OH)2 + H2
2x------------------->2x-------->2x
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
2y----->y-------------------------->y----------->3y
=>\(n_{H_2}=2x+3y=\dfrac{20,832}{22,4}=0,93\) (2)
Từ (1), (2) => x=0,015 (mol) ; y=0,3(mol)
\(\Rightarrow m_{Ba}=0,015.137=2,005\left(mol\right);m_{Al}=0,3.27=8,1\left(g\right)\)
b) Dung dịch B chứa Ba(AlO2)2 : 0,015(mol)
\(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
TH1: Kết tủa chưa đạt giá trị max và còn Ba(AlO2)2 dư
Ba(AlO2)2 + 2HCl + 2H2O → BaCl2 + 2Al(OH)3
Theo PT: \(n_{HCl}=n_{Al\left(OH\right)_3}=0,01\left(mol\right)\)
=> \(CM_{HCl}=\dfrac{0,01}{0,05}=0,2M\)
TH2: Kết tủa đạt giá trị max và bị HCl dư hòa tan 1 phần
Ba(AlO2)2 + 2HCl + 2H2O → BaCl2 + 2Al(OH)3
0,015-------->0,03----------------------------->0,03
\(n_{Al\left(OH\right)_3\left(bihoatan\right)}=0,03-0,01=0,02\left(mol\right)\)
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,02-------->0,06
=> \(\Sigma n_{HCl}=0,03+0,06=0,09\left(mol\right)\)
=> \(CM_{HCl}=\dfrac{0,09}{0,05}=1,8M\)