Axit sunfuric đặc, dư tác dụng với 10 gam hỗn hợp CuO và Cu thì thu được 2,24 lít khí SO2(đktc). Khối lượng ( gam) của CuO và Cu trong hỗn hợp lần lượt là: ( Cu= 64 ,O=16
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cau 17 :
\(n_{SO2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4dac,du}\rightarrow CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
0,1 0,1
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
\(n_{Cu}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
\(m_{CuO}=10-6,4=3,6\left(g\right)\)
Chuc ban hoc tot

Đáp án B
Số mol SO2 thu được là: n SO 2 = 11 , 2 22 , 4 = 0 , 5 mol
Sơ đồ phản ứng:
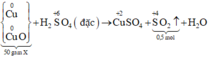
Các quá trình nhường , nhận electron:
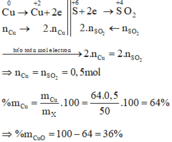

Cho hỗn hợp qua dung dịch \(H_2SO_4\) loãng chỉ có Fe tác dụng.
\(\Rightarrow n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,1 0,1
\(m_{Fe}=0,1\cdot56=5,6g\)
\(\Rightarrow m_{Cu}=10-5,6=4,4g\)

Đáp án C
Trong X, chỉ có Fe tác dụng với dung dịch H2SO4 loãng:


nSO2 = \(\dfrac{2,8}{22,4}\)=0,125 mol
S+6 + 2e → S+4
0,25<-----0,125
=> Số mol e do 3,35 gam hỗn hợp kim loại nhường là 0,25 mol.
Xét phản ứng với Clo
Kim loại + Cl2 → Muối clorua
Có 3,35 gam kim loại phản ứng nên số mol e kim loại nhường cũng là 0,25 mol
Cl20 + 2e → 2Cl-1
0,25 --> 0,25
=> nCl-1 trong muối clorua = 0,25 mol
<=> mCl-1 = 0,25.35,5 = 8,875 gam.
mMuối = mKim loại + mCl-1 = 3,35 + 8,875 = 12,225 gam.

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,1 ( mol )
\(m_{Fe}=0,1.56=5,6g\)
\(\%m_{Cu}=\dfrac{20-5,6}{20}.100=72\%\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\\ Theo.pt:n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ m_{Fe}=0,1.56=5,6\left(g\right)\\ \%m_{Fe}=\dfrac{5,6}{20}=28\%\\ \%m_{Cu}=100\%-28\%=72\%\)

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%
\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Cu+2H_2SO_{4\left(đ\right)}\rightarrow CuSO_4+2H_2O+SO_2\uparrow\\ \Rightarrow n_{Cu}=0,1\left(mol\right)\\ \Rightarrow m_{Cu}=0,1\cdot64=6,4\left(g\right)\\ \Rightarrow m_{CuO}=10-6,4=3,6\left(g\right)\)
có thể giải thích cho em cái phần mCuO = 10 - 6,4 được không ạ