Cho một lượng tinh thể Cu(NO3)2.3H2O vào 300 ml dung dịch NaCl 0,6M thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A, đến khi khối lượng dung dịch giảm 18,65 gam thì dừng điện phân. Nhúng thanh Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 0,035 mol khí NO (sản phẩm khử duy nhất của N+5; đồng thời khối lượng thanh Fe giảm 2,94 gam. Thời gian điện phân là:
A. 6176 giây
B. 6948 giây
C. 8106 giây
D. 7334 giây


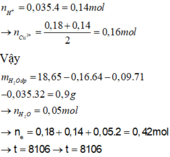
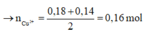
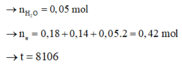







Đáp án C
n N a C l = 0 , 18 m o l
Điện phân dung dịch X sau một thơi gian thấy giảm 18,65 gam
Cho Fe vào dung dịch thu được 0,035 mol NO do vậy dung dịch có H+. Do đó Cl- bị điện phân hết trước Cu2+.
Ta có: 3 F e + 8 H + + 2 N O 3 - → 3 F e 2 + + 2 N O + 4 H 2 O
(do Fe dư).
Lượng Fe bị ăn mòn do phản ứng này là chính bằng khối lượng thanh Fe giảm.
Do vậy Cu2+ bị điện phân hết
Ta có: n H + = 0 , 035 . 4 = 0 , 14 m o l → n C u + = 0 , 18 + 0 , 14 2 = 0 , 16 m o l
Vậy: m H 2 O đ p = 18 , 65 - 0 , 16 . 64 - 0 , 09 . 71 - 0 , 035 . 32 = 0 , 9 g a m
→ n H 2 O = 0 , 05 m o l → n e = 0 , 18 + 0 , 14 + 0 , 05 . 2 = 0 , 42 m o l → t = 8106