Cho một lượng kim loại Al vào dung dịch chứa hỗn hợp gồm a mol HCl; 0,05 mol NaNCb và 0,1 mol KNO3. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X chứa m gam muối, b gam kim loại và 0,125 mol hỗn hợp khí Y (gồm 2 khí không màu trong đó có 1 khí hóa nâu ngoài không khí). Tỉ khối của Y so với H2 là 12,2. Giá trị của m là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Vì Mx = 12,2.2 = 24,4 hỗn hợp khí là NO và H2

Al + 4H+ + NO3- → Al3+ + NO + H2O
0,1 ← 0,4 ← 0,1 ← 0,1
2Al + 6H+ → 2Al3+ + 3H2
1/60 ← 0,05 ← 0,025
Bảo toàn khối lượng m = m Al + m Na+ + m K+ + m NO3- + m Cl-
= ( 0,1 + 1/60) .27 + 23. 0,05 + 0,1.39 + (0,15 – 0,1). 62 + 0,45.35,5
= 27,275 (g)
Đáp án B

Chọn đáp án B
MY = 24,4 ⇒ Y chứa H2 và NO. Đặt nH2 = x mol; nNO = y mol ⇒ nY = x + y = 0,125 mol
mY = 2x + 30y = 0,125 × 24,4. Giải hệ có: x = 0,025 mol; y = 0,1 mol.
Do Y chứa H2 ⇒ X không chứa NO3–. Bảo toàn nguyên tố Nitơ:
nNH4+ = 0,05 + 0,1 – 0,1 = 0,05 mol. Bảo toàn electron: 3nAl phản ứng = 2nH2 + 3nNO + 8nNH4+
⇒ nAl phản ứng = 0,25 mol. X chứa AlCl3, NaCl, KCl, NH4Cl
⇒ m = 0,25 × 133,5 + 0,05 × 58,5 + 0,1 × 74,5 + 0,05 × 53,5 = 46,425 gam.

Fedư => AgNO3,Cu(NO3)2 và Al phản ứng hết, phản ứng
Bảo toàn electron ta có: ne cho= nenhận
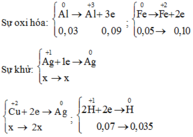
Bảo toàn electron ta có: ne cho= nenhận
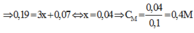

Chất rắn Y chứa 3 kim loại là Ag, Cu, Fe dư.
Y + HCl → 0,035 mol H2 nên n(Fe trong Y) = 0,035 mol
→ n(Fe phản ứng) = 0,05 – 0,035 = 0,015 mol
Đặt n(AgNO3) = x ; n(Cu(NO3)2) = x
Áp dụng ĐLBT mol e : n(AgNO3) + 2n(Cu(NO3)2) = n(Al) + n(Fe phản ứng)
→ x = 0,04 mol
→ CM(AgNO3) = CM(Cu(NO3)2) = 0,4M → Đáp án B

a. nH2=4,368/22,4=0,195
Mg+2HCl->MgCl2+H2
Mg+H2SO4->MgSO4+H2
2Al+6HCl->2AlCl3+3H2
2Al+3H2SO4->Al2(SO4)3+3H2
Theo phương trình nH2=nHCl/2+nH2SO4
Nếu axit hết
->nH2=nHCl/2+nH2SO4
->nH2=0,25/2+0,125=0,25>0,195
->Axit phải dư
b. Gọi số mol Mg và Al là a và b
Ta có 24a+27b=3,87
Theo pt : nH2=nMg+1,5nAl
->0,195=a+1,5b
->a=0,06; b=0,09
->%mMg=0,06.24/3,87=37,21%
->%mAl=62,79%
HT

Chọn B
Y gồm 3 kim loại: Ag, Cu, Fe dư.
Khi cho Y + HCl ⇒ nFe dư = nH2 = 0,035 ⇒ nFe phản ứng = 0,05 – 0,035 = 0,015
Đặt [Ag+] = [Cu2+] = x
Bảo toàn ne ⇒ nAg+ + 2nCu2+ = 2nFe phản ứng + 3nAl
⇒ 0,1x + 0,1.2x = 2.0,015 + 3.0,03 ⇒ x = 0,4
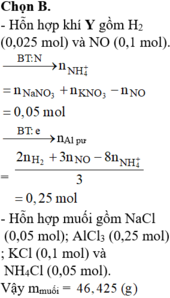
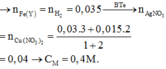
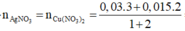
Đáp án B
MY = 24,4 ⇒ Y chứa H2 và NO. Đặt nH2 = x mol; nNO = y mol
⇒ nY = x + y = 0,125 mol
mY = 2x + 30y = 0,125 × 24,4.
Giải hệ có: x = 0,025 mol; y = 0,1 mol.
Do Y chứa H2 ⇒ X không chứa NO3–.
Bảo toàn nguyên tố Nitơ:
nNH4+ = 0,05 + 0,1 – 0,1 = 0,05 mol.
Bảo toàn electron: 3nAl phản ứng = 2nH2 + 3nNO + 8nNH4+
⇒ nAl phản ứng = 0,25 mol. X chứa AlCl3, NaCl, KCl, NH4Cl
⇒ m = 0,25 × 133,5 + 0,05 × 58,5 + 0,1 × 74,5 + 0,05 × 53,5 = 46,425 gam