Số mol của 20 gam NaOH sodium hydroxide là: ( Na =23, O = 16, H =1)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\\ PTHH:NaOH+HCl\rightarrow NaCl+H_2O\\ n_{NaCl}=n_{NaOH}=0,2\left(mol\right)\\ m_{NaCl}=58,5.0,2=11,7\left(g\right)\)

Bạn cần giúp tất cả các câu này hả? Bạn cần đáp án hay chi tiết?

\(n_{Na_2O}=\dfrac{6,2}{62}=0,1mol\\ Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=0,1.2=0,2mol\\ C_{M_X}=C_{M_{NaOH}}=\dfrac{0,2}{2}=0,1M\)
\(n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
PT: \(Na_2O+H_2O\rightarrow2NaOH\)
Theo PT: \(n_{NaOH}=2n_{Na_2O}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,2}{2}=0,1\left(m\right)\)

PTHH: HCl + NaOH --> NaCl + H2O
______0,4<--0,4
=> mNaOH = 0,4.40 = 16(g)
=> \(C\%NaOH=\dfrac{16}{80}.100\%=20\%\)

Đáp án : A
Qui hỗn hợp E về E2 : x mol đipeptit (Gly,Ala) và y mol Este
Ta thấy NaOH và H2O không cần O2 để đốt ;
CH3OH cần 1,5y mol O2 để đốt
=> Bảo toàn O có : 0,7 = 0,625 + 1,5y
=> y = 0,05 mol
Mặt khác , hỗn hợp qui đổi E2 đốt cháy cho số mol :
n C O 2 = n H 2 O = (3x + 2y + 0,7.2)/3 = (x + 0,5) mol
=> mE2 = 14.(0,5 + x) + 76x + 32y (g)
Mà nNaOH dùng = (2x + 0,05) mol
Bảo toàn khối lượng :
14.(0,5 + x) + 76x + 32y + 40.(2x + 0,05) = 24,2 + 18x + 32y
=> x = 0,1 mol
=> Cố C trung bình trong E2 = 0,6/(0,1 + 0,05) = 4
=> Số Ceste ≤ 3. Có 2 trường hợp xảy ra :
TH1 : este là HCOOCH3 .
Gọi số mol Gly = a ; Ala = b thì có :
=> 2a + 3b = 0,6 – 0,05.2 và a + b = 0,2
=> a = b = 0,1 mol (Loại do nGly > nAla)
TH2 : este là CH3COOCH3
=> 2a + 3b = 0,45 và a + b = 0,2
=> a = 0,15 ; b = 0,05 (TM)
=> a : b = 0,15 : 0,05 = 3 : 1

Bài 8: Bạn bổ sung thêm đề phần này nhé.
Bài 9: Bài này giống bài 2 bên dưới nhé.
Bài 10:
\(n_{Fe\left(NO_3\right)_3}=0,3.1=0,3\left(mol\right)\)
PT: \(Fe\left(NO_3\right)_3+3NaOH\rightarrow3NaNO_3+Fe\left(OH\right)_3\)
a, \(n_{NaOH}=3n_{Fe\left(NO_3\right)_3}=0,9\left(mol\right)\Rightarrow V_{NaOH}=\dfrac{0,9}{2}=0,45\left(l\right)\)
b, \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_2}=\dfrac{1}{2}n_{Fe\left(NO_3\right)_3}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,15.160=24\left(g\right)\)
Bài 11:
Ta có: \(n_{NaOH}=\dfrac{200.12\%}{40}=0,6\left(mol\right)\)
PT: \(2NaOH+FeCl_2\rightarrow2NaCl+Fe\left(OH\right)_2\)
a, \(n_{FeCl_2}=n_{Fe\left(OH\right)_2}=\dfrac{1}{2}n_{NaOH}=0,3\left(mol\right)\Rightarrow C\%_{FeCl_2}=\dfrac{0,3.127}{100}.100\%=38,1\%\)
b, \(n_{NaCl}=n_{NaOH}=0,6\left(mol\right)\)
Ta có: m dd sau pư = 200 + 100 - 0,3.90 = 273 (g)
\(\Rightarrow C\%_{NaCl}=\dfrac{0,6.58,5}{273}.100\%\approx12,86\%\)

\(Na_2O+H_2O\rightarrow2NaOH\)
Khối lượng NaOH ban đầu:
\(m_{NaOH}=\dfrac{500.10}{100}=50g\)
Khối lượng NaOH được tạo ra từ Na2O:
\(m_{NaOH}=2.n_{Ca_2O}.M_{NaOH}=2.\dfrac{31}{62}.40=40g\)
Khối lượng NaOH sau cùng là: 50 + 40 = 90g
Khối lượng dd sau: 31 + 500 = 531g
Nồng độ % dd NaOH:
\(C\%_{NaOH}=\dfrac{90}{531}.100\%=16,95\%\)
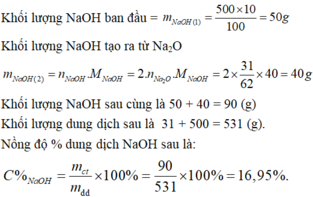
\(n_{NaOH}=\dfrac{20}{23+16+1}=\dfrac{20}{40}=0,5\left(mol\right)\)
\(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)