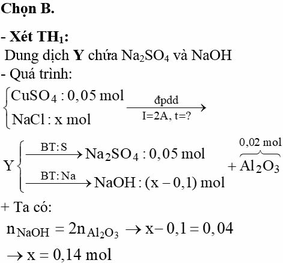
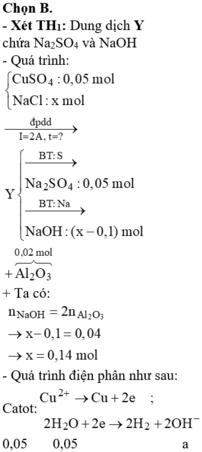
Điện phân dung dịch hỗn hợp NaCl và 0,05 mol CuSO4 bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn). Sau thời gian t giây thì ngừng điện phân, thu được khí ở hai điện cực có tổng thể tích là 2,352 lít (đktc) và dung dịch X. Dung dịch X hòa tan tối đa 2,04 gam Al2O3. Giả sử hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của t là
A. 9408.
B. 7720.
C. 9650.
D. 8685.







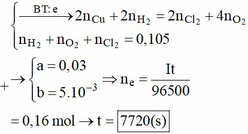

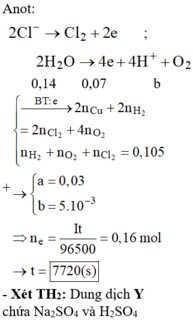
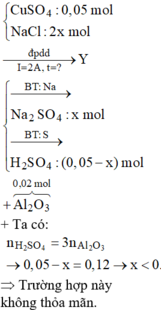
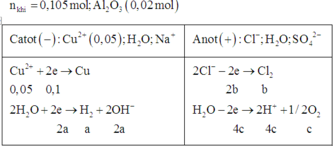

Đáp án B.
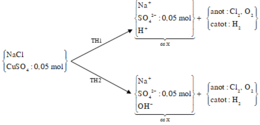
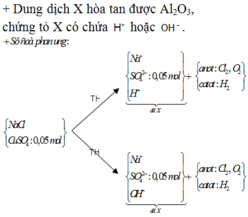
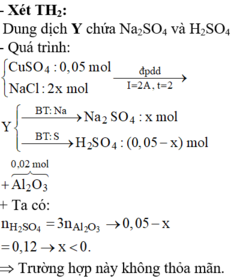
« Nhận xét: dung dịch X hòa tan 0,02 mol Al2O3 thì có 2 khả năng: X chứa 0,04 mol NaOH hoặc 0,06 mol H2SO4. Dựa vào câu: khí thu được ở hai điện cực → xét trường hợp 0,04 mol NaOH trước (vì có NaOH ứng với ở catot thoát ra khí H2; nếu trường hợp này không đúng, sẽ giải trường hợp còn lại).
Thật vậy, X chứa 0,04 mol NaOH + 0,05 mol Na2SO4 → có 0,14 mol NaCl.
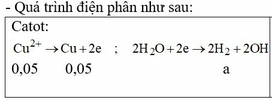
→ Đọc dung dịch ra lần lượt là 0,05 mol CuCl2 + 0,04 mol HCl + ? mol H2O.
? mol H2O sinh ? mol H2 và ½ ? mol O2 mà tổng mol khí 2 cực là 0,105 mol → ? = 0,01 mol.
Theo đó, tổng mol electron trao đổi = 0 , 05 × 2 + 0 , 04 + 0 , 01 × 2 = 0 , 16 mol
→ t = 96500 × 0 , 16 : 2 = 7720 s.