Cho m gam kim loại M vào 200 ml dung dịch HCl 0,1M tới phản ứng hoàn toàn thu được 0,56 lít khí ở đktc và dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư thu được m1 gam kết tủa. Giá trị của m1 là ?
A. 9,83
B. 2,87
C. 5,74
D. 6,35
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Dung dịch Y chứa Fe2+ (x mol), Cu2+ (y mol), H+ , Cl- (1 mol).
Khi cho Y tác dụng với dung dịch AgNO3 thì:
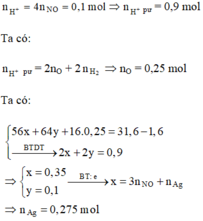
Kết tủa thu được gồm AgCl (1 mol) và Ag (0,275 mol)
=> m = 173,2 (g)

Đáp án C
Do X tác dụng với HCl sinh ra khí nên Al dư, CuSO4 và AgNO3 hết
nAl dư=nH2/1,5=0,02 mol
nCu=nCuSO4=0,03 mol
nAg=nAgNO3=0,03 mol
BT e: 3nAl pư=2nCu+nAg=> nAg pư=(0,03.2+0,03)/3=0,03 mol
m1=(0,03+0,02).27=1,35 gam
m2=0,03.64+0,03.108+0,02.27=5,7 gam

Giải thích:
nHCl = 0,2.0,5 = 0,1 (mol); nH2 = 2,24 :22,4 = 0,1 (mol)
=> nHCl < 2nH2
=> R là kim loại kiềm hoặc kiềm thổ, phản ứng hết với HCl sau đó phản ứng được với H2O
2R + 2nHCl → RCln + nH2↑
0,1 → 0,05
2R + 2nH2O → 2R(OH)n + nH2↑
0,1/n ←0,05
RCln + nAgNO3 → nAgCl↓ + R(NO3)n
2R(OH)n + 2nAgNO3 → nAg2O↓ + R(NO3)n + nH2O
0,1/n → 0,05
=> m↓ = mAgCl + mAg2O = 0,1.143,5 + 0,05. 232 = 25,95(g)
Chú ý:
Tránh sai lầm khi chỉ tính khối lượng kết tủa là AgCl khi đó sẽ ra 14,35 g => chọn ngay đáp án B sẽ dẫn đến sai lầm
Đáp án A

Đáp án A
Do X tác dụng được với HCl ⇒ Al dư. Bảo toàn electron: nAl dư = 0,01 mol.
Bảo toàn gốc NO3: nNO3–/dung dịch sau = 0,09 mol. Bảo toàn điện tích: nAl3+ = 0,03 mol.
► Bảo toàn nguyên tố Al: m1 = 27 × (0,03 + 0,01) = 1,08(g). Lại có :
X gồm 0,03 mol Cu; 0,03 mol Ag và 0,01 mol Al dư ||⇒ m2 = 5,43(g)
⇒ chọn A

a)X gồm Fe,Ag
\(Fe + 2AgNO_3 \to Fe(NO_3)_2 + Ag(1)\\ Fe + 2HCl \to FeCl_2 + H_2(2)\\ 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(3)\\ 2Ag + 2H_2SO_4 \to Ag_2SO_4 + SO_2 + 2H_2O(4)\\\)
b) Phần 1,gọi n\(n_{Ag} = a(mol)\)
Theo PTHH (2) : \(n_{Fe} = n_{H_2} = 0,1(mol)\)
Suy ra : m2 = 0,1.56 + 108a = 5,6 + 108a(gam)
Phần 2, \(n_{Ag} = ak(mol) ; n_{Fe} = 0,1k(mol)\)
Theo PTHH (3)(4) : \(n_{SO_2} = \)0,5.ak + 0,1k.1,5 = 0,5ak + 0,15k = 0,4
⇒ k(0,5a + 0,15) = 0,4(1)
m3 = 108.ak + 0,1k.56 (gam)
Ta có :
\(m_3 - m_2 = 16,4 \Rightarrow m_3 = 16,4 + m_2\)
⇔ k(108a + 5,6) = 16,4 + 5,6 + 108a = 22+ 108a(2)
Ta lấy (1) : (2), ta có :
\(\dfrac{0,5a + 0,15}{108a + 5,6} = \dfrac{0,4}{22 + 108a}\)⇒ a = 0,1
Vậy : k = \(\dfrac{0,4}{0,5a + 0,15} = 2\)
Vậy X gồm :
Fe : 0,1 + 0,1.2 = 0,3(mol)
Ag : 0,1 + 0,1.2 = 0,3(mol)
Fe + 2AgNO3 →Fe(NO3)2 + 2Ag
0,3.....0,3...............................0,3.........(mol)
Vậy :
m = (0,3 + 0,3).56 = 33,6 gam
V = \(\dfrac{0,3}{1}\) = 0,3(lít)
phần tính a bạn giải chi tiết dùm mình dc không, mình giải ko ra

Chọn C
m2 gam X có thể phản ứng với HC1 tạo H2 Þ Có Al dư Þ nAl dư = 0,03/1,5 = 0,02
Vì AI dư Þ Toàn bộ Ag+ và Cu2+ đã bị khử hết về kim loại đơn chất
BTE Þ 3nAl phản ứng = 0,03x2 + 0,03 = 0,09 Þ nAl phản ứng = 0,03
Vậy m1 = (0,03 + 0,02)x27 = 1,35; m2 = 0,02x27 + 0,03x64 + 0,03x108 = 5,7
Đáp án : D
nH2 = 0,025 mol > nHCl = 0,02 mol
=> Kim loại M có thể tan trong nước tạo bazo
=> nCl = 0,02 mol ; nOH = 0,03 mol
=> Kết tủa gồm : 0,02 mol AgCl ; 0,015 mol Ag2O
=> m1 = 6,35g