Cho m gam Al vào dung dịch HCl dư đến khi ngừng thoát khí thấy khối lượng phần dung dịch tăng 14,4 gam so với dung dịch HCl ban đầu. Tính khối lượng muối tạo thành.
A. 71,2 gam.
B. 80,1 gam.
C. 16,2 gam.
D. 14,4 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
2Al + 6HCl → 2AlCl3 + 3H2↑. Bảo toàn khối lượng:
mAl + mdung dịch HCl = mdung dịch sau phản ứng + mH2.
⇒ mtăng = mdung dịch sau – mdung dịch HCl = mAl – mH2 = 14,4(g).
Mặt khác, nH2 = 1,5.nAl ||⇒ giải hệ có: nAl = 0,6 mol; nH2 = 0,9 mol.
► mmuối = 0,6 × 133,5 = 80,1(g) ⇒ chọn B.

Giải thích: Đáp án B
2Al + 6HCl → 2AlCl3 + 3H2
Hướng dẫn giải :
mdd tắng= m – mH2 = 27nAl – 3nAl → nAl=0,6 mol → mAlCl3 =0,6.133,5=80,1 g

a, Ta có: 65nZn + 27nAl = 11,9 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ mZn = 0,1.65 = 6,5 (g)
mAl = 0,2.27 = 5,4 (g)
b, Theo PT: nZnCl2 = nZn = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
⇒ m muối = 0,1.136 + 0,2.133,5 = 40,3 (g)
c, Theo PT: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{10\%}=292\left(g\right)\)

Đáp án B
Do dung dịch Y tăng 21,28 gam.
→ m X = 28 , 96 - 21 , 28 = 7 , 68 g a m T a c ó : n X = 7 , 68 9 , 6 . 4 = 0 , 2 m o l
Do vậy ta giải được số mol CO2 và NO trong X lần lượt là 0,06 mol và 0,08 mol.
Vậy số mol FeCO3 là 0,06 mol.
Do khi thêm AgNO3 vào Y có xuất hiện NO nên H+ dư nên Y không có NO3- dư.
Bảo toàn N: n N H 4 + = 0 , 24 - 0 , 06 . 2 - 0 , 08 = 0 , 04 m o l
Gọi a, b lần lượt là số mol Mg, Fe3O4, c là số mol HCl.
Do vậy kết tủa chứa AgCl c mol và Ag.
→ 24 a + 232 b + 0 , 06 . 116 = 28 , 96
Do cho AgNO3 vào sinh ra 0,03 mol NO nên H+ dư 0,12 mol.
Bảo toàn e kết hợp bảo toàn điện tích:
c= 0,04+8b+0,06.2+0,08.3+0,06.8+0,04.8+0,12
Bảo toàn e:
n A g = 2 a + b + 0 , 06 - 0 , 04 . 8 - 0 , 08 . 3 - 0 , 03 . 3 - 0 , 06 . 8 = 2 a + b - 1 , 07 → 143 , 5 c + 108 ( 2 a + b - 1 , 07 ) = 238 . 58
Giải được: a=0,53; b=0,04; c=1,64.
%Mg= 43,92%

Đáp án B
Do dung dịch Y tăng 21,28 gam.
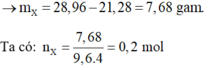
Do vậy ta giải được số mol CO2 và NO trong X lần lượt là 0,06 mol và 0,08 mol.
Vậy số mol FeCO3 là 0,06 mol.
Do khi thêm AgNO3 vào Y có xuất hiện NO nên H+ dư nên Y không có NO3- dư.
Bảo toàn N:
![]()
Gọi a,b lần lượt là số mol Mg, Fe3O4, c là số mol HCl.
Do vậy kết tủa chứa AgCl c mol và Ag.
![]()
Do cho AgNO3 vào sinh ra 0,03 mol NO nên H+ dư 0,12 mol.
Bảo toàn e kết hợp bảo toàn điện tích:
c = 0,04 + 8b + 0,06.2 + 0,08.3 + 0,06.8 + 0,04.8 + 0,12
Bảo toàn e:
![]()
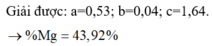

Chú ý: Mỗi lần hỏi bạn up lên từng câu hỏi thôi, không nên đưa một lúc nhiều câu hỏi trong 1 lần hỏi, vì như thế chỉ có 1 câu được trả lời thôi nhé.
HD:
Bài 1.
Vì Cu đứng sau H trong dãy các kim loại nên Cu không phản ứng với HCl.
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,075 mol
Theo phản ứng trên, số mol Fe = số mol H2 = 0,075 mol. Suy ra khối lượng Fe = 56.0,075 = 4,2 g.
Khối lượng Cu = 8 - 4,2 = 3,8 g. Từ đó, %Fe = 4,2.100/8 = 52,5%; %Cu = 100 - 52,5 = 47,5%.

a)
Gọi $n_{CaCO_3} = a; n_{MgCO_3} = b$
$\Rightarrow 100a + 84b = 28,4(1)$
$CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$n_{CO_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{CaCO_3} = \dfrac{0,2.100}{28,4}.100\% = 70,42\%$
$\%m_{MgCO_3} = 100\% -70,42\% = 29,58\%$
b)
$n_{HCl\ pư} = 2n_{CO_2} = 0,6(mol)$
$n_{HCl\ dư} = 0,6.1\% = 0,006(mol)$
$n_{HCl\ đã\ dùng} = 0,6 + 0,006 = 0,606(mol)$
$m_{dd\ HCl} = \dfrac{0,606.36,5}{29,2\%} = 75,75(gam)$
$V_{dd\ HCl} = \dfrac{75,75}{1,25} = 60,6(ml)$
Chọn đáp án B
2Al + 6HCl → 2AlCl3 + 3H2↑. Bảo toàn khối lượng:
mAl + mdung dịch HCl = mdung dịch sau phản ứng + mH2.
⇒ mtăng = mdung dịch sau – mdung dịch HCl = mAl – mH2 = 14,4(g).
Mặt khác, nH2 = 1,5.nAl ||⇒ giải hệ có: nAl = 0,6 mol; nH2 = 0,9 mol.
► mmuối = 0,6 × 133,5 = 80,1(g) ⇒ chọn B.
dễ thế , đi copy trang khác xong vô paste lại là xong bạn nhỉ?