Cho 16,25 gam một kim loại hóa trị II tác dụng hết với dung dịch hydrochloric
acid HCl thì thu được 6,1975 lít khí Hydrogen (25độC, 1bar). Hãy xác định đó là kim
loại nào?
Bài 11. Để hòa tan 5,1g oxide của một kim loại hóa trị III, người ta phải dùng 200 mL
dung dịch HCl 1,5M. Tìm công thức hóa học của oxide này
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: M + 2H2O → M(OH)2 + H2
Mol: 0,1 0,1 0,1
\(\Rightarrow M_M=\dfrac{4}{0,1}=40\left(g/mol\right)\)
⇒ M là canxi (Ca)
\(C\%_{ddCa\left(OH\right)_2}=\dfrac{0,1.74.100\%}{500}=1,48\%\)
b) \(m_{Ca\left(OH\right)_2}=200.1,48=2,96\left(g\right)\Rightarrow n_{Ca\left(OH\right)_2}=\dfrac{2,96}{74}=0,04\left(mol\right)\)
PTHH: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Mol: 0,04 0,08
\(V_{ddHCl}=\dfrac{0,08}{2}=0,04\left(l\right)=40\left(ml\right)\)

\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
0,15<-0,3<---0,15<----0,15
a. \(M=\dfrac{8,4}{0,15}=56\left(g/mol\right)\)
Vậy M là kim loại Fe.
b. \(n_{NaOH}=0,5.1=0,5\left(mol\right)\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
0,2<-----0,2
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
0,15----->0,3
\(m_{dd.HCl}=\dfrac{\left(0,3+0,2\right).36,5.100\%}{10\%}=182,5\left(g\right)\)
\(m_{dd.A}=8,4+182,5-0,15.2=190,6\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{127.0,2.100\%}{190,6}=13,33\%\)
\(C\%_{HCl.dư}=\dfrac{0,3.36,5.100\%}{190,6}=5,75\%\)

Sửa đề : Xác định kim loại Z biết rằng 500ml dung dịch HCl 1M hòa tan dư 4,8g kim loại đó
nH2=0,05 mol
PTHH:
Fe+2HCl→FeCl2+H2↑
Z + 2HCl →ZCl2+H2↑
Đặt công thức chung của hỗn hợp là N
N + 2HCl → NCl2 + H2
0,05______________0,05
⇒MN=\(\dfrac{2}{0,05}\)=40
Vì MFe =56>40
⇒MZ <40 (1)
Ta có : nHCl<0,5.1=0,5 mol
Z + 2HCl →ZCl2+H2↑
=> nZ < 0,25
=> MZ >\(\dfrac{4,8}{0,25}=19,2\)(2)
Từ (1), (2), ta có 19,2<MZ <40
Mà Z hóa trị II
⇒Z là Magie
dạ em cảm ơn nhưng nếu đề cho thêm 1M thì em cũng làm được ạ! em chỉ muốn mọi người xác nhận xem đề chuẩn chưa thoi ạ

\(n_{H2\left(dktc\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_R=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
⇒ \(M_R=\dfrac{5,4}{0,2}=27\left(dvc\right)\)
Vậy kim loại R là nhôm
b) \(2Al+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(n_{SO2}=\dfrac{0,3.3}{2}=0,3\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt
a) PTHH: \(2R+3H_2SO_4\rightarrow R_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) \(\Rightarrow n_R=0,2\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{5,4}{0,2}=27\) \(\Rightarrow\) R là Nhôm (Al)
b) PTHH: \(2Al+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Theo PTHH: \(n_{SO_2}=0,3\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,3\cdot22,4=6,72\left(l\right)\)

Đáp án D.
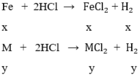
gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
số mol H2 là 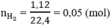
theo bài ra ta có hệ phương trình
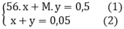
từ (2) → x= 0,05 – y
thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
2,3 = 56y – My
→ y = 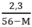
Ta có 0 < y < 0,05
y > 0 ↔ 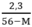 > 0 → 56 – M > 0 ⇒ M < 56
> 0 → 56 – M > 0 ⇒ M < 56
y < 0,05 ↔ 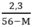 < 0,05 → 2,3 < 0,05(56 – M) → M < 10
< 0,05 → 2,3 < 0,05(56 – M) → M < 10
Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be



Bài 10:
Gọi kim loại cần tìm là R
\(\Rightarrow n_R=\dfrac{16,25}{M_R}\left(mol\right);n_{H_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\\ PTHH:R+2HCl\rightarrow RCl_2+H_2\\ \Rightarrow n_R=n_{HCl}\\ \Rightarrow\dfrac{16,25}{M_R}=0,25\Rightarrow M_R=65\)
Vậy R là kẽm (Zn)
Bài 11:
Gọi CTHH của oxide là \(R_2O_3\)
\(\Rightarrow n_{R_2O_3}=\dfrac{5,1}{2M_R+48}\left(mol\right);n_{HCl}=1,5\cdot0,2=0,3\left(mol\right)\\ PTHH:R_2O_3+6HCl\rightarrow2RCl_3+3H_2O\\ \Rightarrow n_{R_2O_3}=\dfrac{1}{6}n_{HCl}=0,05\left(mol\right)\\ \Rightarrow\dfrac{5,1}{2M_R+48}=0,05\\ \Rightarrow2M_R+48=102\\ \Rightarrow M_R=27\)
Do đó R là nhôm (Al)
Vậy CTHH oxide là \(Al_2O_3\)