Đem hoà tan 90 gam một loại gang (trong đó Cacbon chiếm 6,667% về khối lượng) vào dung dịch HNO3 đặc nóng dư. Thể tích khí NO2 (,sản phẩm khử duy nhất, ở đktc) là:
A. 100,8 lít
B. 157,5 lít
C. 112 lít
D. 145,6 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
mC = 90.6,667/100 = 6 (g)
=> nC = 0,5 mol
mFe = 84 (g) => nFe = 1,5 mol
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
nFe= 1,5 => nNO2=4,5 mol
C + 4HNO3 → 4NO2 + CO2 + 2H2O
nC=nCO2=0,5 mol
n khí = nNO2 + nCO2 = 4,5 + 0,5 = 5 mol
=> V = 112 lít

Đáp án : C
Bảo toàn e : 3nFe = nNO2 => nFe = 0,112 mol
=> mFe =6,72g

Cho Fe vào HNO3 thì có quá trình:
+ Cho e : Fe Fe+3 + 3e
+ Nhận e: N+5 + 1e N+4
DLBt e có 3nFe= nNO2 = V/22,4 => V=0,09.22,4=2,016 l
=>C

Đáp án D
Bảo toàn e : 2nM = nNO2 => nM = 0,0875 mol
=> Mkimloại = 64g => Kim loại cần tìm là Cu

Đáp án D
Gọi số mol của Cu là a mol
Xét giai đoạn m gam Cu tác dụng với dung dịch HNO3:
Sơ đồ phản ứng:
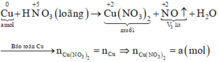
Các quá trình nhường, nhận electron:
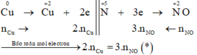
Xét giai đoạn m gam Cu tác dụng với H2SO4 đặc:
Sơ đồ phản ứng:
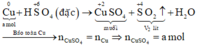
Các quá trình nhường, nhận electron:


HNO3 đặc nên sản phẩm khử sẽ là NO2
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{NO_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}+2n_{Cu}=n_{NO_2}\) \(\Rightarrow3a+2b=0,12\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{1}{2}a\left(mol\right)\\n_{CuO}=n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow160\cdot\dfrac{1}{2}a+80b=4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\end{matrix}\right.\) \(\Rightarrow m_{hh}=0,02\cdot56+0,03\cdot64=3,04\left(g\right)\)

Đáp án A
· Quy đổi X tương đương với hỗn hợp gồm x mol Cu, y mol Fe, z mol O

· Y + HNO3 → 2,8125m g muối + 1,6 mol NO2
⇒ → BTe 2 x + 3 y + 2 n o phản ứng = 2 z + n NO 2 ⇒ 2 x + 3 y - 2 z = 1 mol 2 , 8125 m = 188 x + 242 y = 2 , 8125 . 128 z ( 2 )
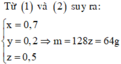
Đáp án : D