Cho 142 gam P2O5 vào 500 gam dung dịch H3PO4 23,72% được dung dịch A. Tìm nồng độ % của dung dịch A.
A. 63%.
B. 32%.
C. 49%.
D. 56%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nP2O5=1 mol
nH3PO4=23,72%.500/98=1,21 mol
P2O5 + 3H2O → 2H3PO4
1 3 2
nH3PO4=2+1,21=3,21 mol => C% H3PO4 (dd A) = 3,21.98/(142+500)=49%

Chọn đáp án A
Có ![]() mol.
mol.
Phản ứng:
![]()
⇒ ![]() = 2 mol.
= 2 mol.
sẵn có trong 500 gam H3PO4 24,5% là 1,25 mol H3PO4
⇒ sau phản ứng thu được 642 gam dung dịch chứa 3,25 mol H3PO4
⇒ ![]() = 3,25 × 98 ÷ 642 × 100%
= 3,25 × 98 ÷ 642 × 100%
= 49,61%

Đáp án A
P2O5 + 3H2O -> 2H3PO4
1 mol -> 2 mol
=> åmH3PO4 = 98.2 + 500.24,5% = 318,5g
mdd sau = 642g
=> C% H3PO4 = 49,61%

nH3PO4 ban đầu = 500. 23,72% ÷ 98 = 1,21 mol
nP2O5 = 1 mol; Bảo toàn P:⇒ n H3PO4 = 2
mH3PO4 lúc sau = 3,21. 98 = 314,58g
m dung dich sau = 500 + 142 = 642g
⇒C% = 314,58÷ 514.100%= 49%
Đáp án D.

Đáp án : A
Bảo toàn P : nH3PO4 sau = nH3PO4 trước + 2nP2O5 = 1,204 mol
mdd sau = mdd trước + mP2O5 = 171g
=> C%H3PO4 sau = 69%

\(n_{P_2O_5}=\dfrac{99,4}{142}=0,7\left(mol\right)\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
0,7 2,1 1,4
a, \(m_{H_3PO_4}=1,4.98=137,2\left(g\right)\)
\(m_{ddH_3PO_4}=99,4+500=599,4\left(g\right)\)
Kl nước trong dd A :
\(m_{H_2O}=599,4-137,2=462,2\left(g\right)\)
\(b,C\%_{H_3PO_4}=\dfrac{137,2}{599,4}.100\%\approx22,89\%\)
\(c,C_M=\dfrac{n}{V}=\dfrac{1,4}{0,5}=2,8M\)
Đáp án C
Ta có nP2O5 = 1 mol
⇒ nH3PO4 thêm = 2 mol.
⇒ ∑mH3PO4 = 2×98 + 500×0,2372 = 314,6 gam.
+ Ta có mDung dịch A = 142 + 500 = 642 gam.
⇒ C%H3PO4 =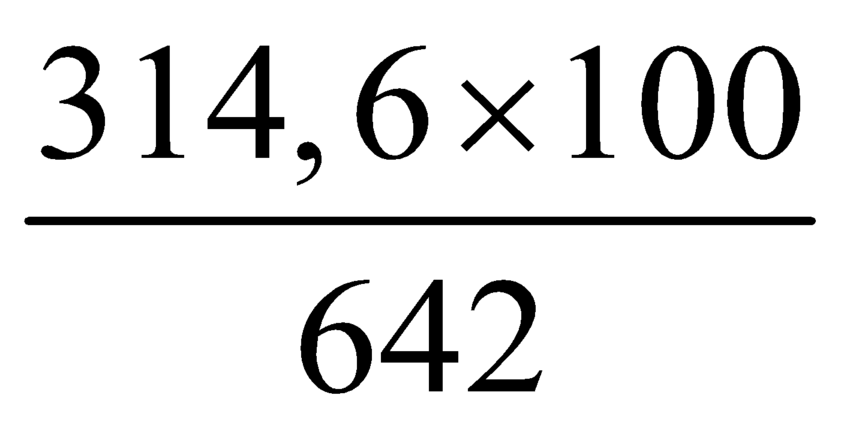 ≈ 49%
≈ 49%