Điện phân dung dịch chứa AgNO3 với điện cực trơ trong thời gian t (s), cường độ dòng điện 2A thu được dung dịch X. Cho m gam bột Mg vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn thu được 0,336 gam hỗn hợp kim loại, 0,112 lít hỗn hợp khí Z (đktc) gồm NO và N2O có tỉ khối đối với H2 là 19,2 và dung dịch Y chứa 3,04 gam muối. Cho toàn bộ hỗn hợp bột kim loại trên tác dụng với dung dịch HCl dư thu được 0,112 lít khí H2 (đktc). Giá trị của t là
A. 2895,10
B. 2219,40
C. 2267,75
D. 2316,00



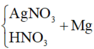
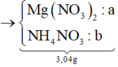
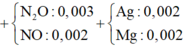
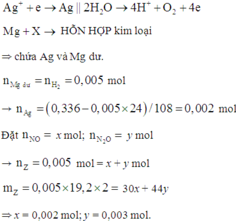
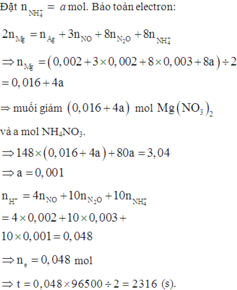
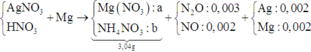


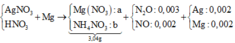
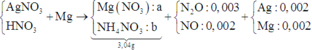


Đáp án D
Đặt nNO = x; nN2O = y ⇒ nZ = x + y = 0,005 mol; mZ = 30x + 44y = 0,005 × 19,2 × 2.
||⇒ giải hệ có: x = 0,002 mol; y = 0,003 mol || nMg dư = nH2 = 0,005 mol
⇒ nAg = (0,336 – 0,005 × 24) ÷ 108 = 0,002 mol. Đặt nMg phản ứng = a. Bảo toàn electron:
2nMg phản ứng = 3nNO + 8nN2O + 8nNH4NO3 + nAg ⇒ nNH4NO3 = (0,25a – 0,004) mol
||⇒ mmuối = 148a + 80.(0,25a – 0,004) = 3,04(g) ⇒ a = 0,02 mol. Lại có:
ne = nH+ = nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol ⇒ t = 2316(s)