Nguyên tố Y là phi kim thuộc chu kỳ 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M hợp chất có công thức MY, trong đó M chiếm 66,67% về khối lượng. Kim loại M là
A. Zn
B. Fe
C. Mg
D. Cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Y công thức Oxit cao nhất là YO3 Y có hóa trị VI
Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 Y là S Hợp chất M là MS
M chiếm 63,64% khối lượng:
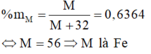

Nguyên tố Y là phi kim thuộc chu kì 3, có công thức oxit cao nhất là YO3
→ Y thuộc nhóm VIA → Y là S (lưu huỳnh).
%M = M/(M=32) = 63,64% →M = 56 (Fe)
Chọn đáp án D

Đáp án C
Y công thức Oxit cao nhất là YO3 ⇒ Y có hóa trị VI
⇒ Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 ⇒ Y là S ⇒ Hợp chất M là MS
M chiếm 63,64% khối lượng:
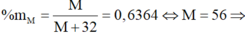 M là Fe
M là Fe

*Xác định Y:
Y thuộc chu kì 2 => Y có 2 lớp e
Công thức oxit cao nhất của Y là YO2
=> Y có hóa trị IV
=> Y thuộc nhóm IVA
=> Y có 4e lớp ngoài cùng
=> Cấu hình e của Y: 1s22s22p2
=> Y là Cacbon
*Xác định M:
Hợp chất MC2
\(\%m_C=\dfrac{2.12}{M+2.12}.100=37,5\%\)
=> M=40 (Ca)
Vậy M là Ca

CT oxit cao nhất là YO3.
⇒ Y có hóa trị cao nhất với oxy = 6
Vậy Y ở nhóm VIA, chu kỳ 3.
Cấu hình e-: 1s2 2s2 2p6 3s2 3p4.
ZY là 16 (S) ⇒ MY : MS
Mặt khác:
Nguyên tố Y là phy kim thuộc chu kì 3 , có công thức oxit cao nhất là YO3 \(\Rightarrow Y\)là \(S\)
Nguyên tố S tạo bởi 2 kim loại M hợp chất có CT MS
\(\%M=\frac{M_M}{M_M+32}=63,64\%\Rightarrow M_M=56\Rightarrow M\)là \(Fe\)

Câu 1,2
Cho nước vào hỗn hợp, lọc bỏ phần không tan
Cho thêm dung dịch CaCl2 tới dư vào, lọc bỏ phần không tan
$CaCl_2 + Na_2SO_4 \to CaSO_4 + 2NaCl$
$CaCl_2 + MgSO_4 \to CaSO_4 + MgCl_2$
Dung dịch gồm : NaCl,MgCl2,Na2SO4,CaCl2
Cho dung dịch NaOH dư vào, lọc bỏ phần không tan
$MgCl_2 + 2NaOH \to Mg(OH)_2 + 2NaCl$
Dung dịch gồm : NaCl,Na2SO4,NaOH,CaCl2
Cho thêm dung dịch H2SO4 tới dư vào, lọc bỏ phần không tan, cho bay hơi dung dịch
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$CaCl_2 + H_2SO_4 \to CaSO_4 + 2HCl$
Chất rắn khan gồm : Na2SO4,NaCl
Cho dung dịch BaCl2 tới dư vào, lọc dung dịch
$BaCl_2 + Na_2SO_4 \to BaSO_4 + 2NaCl$
Dung dịch gồm : BaCl2,NaCl
Cho dung dịch H2SO4 tới dư vào, cô cạn dung dịch . Ta được naCl tinh khiết
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
TK: nếu là 67 thì
1.1
M là Fe (26); A là S (16) công thức là FeS2
Giải thích các bước giải:
Ta có %M=46,67% -> %A=53,33%
Ta có : M=n+p; A=n'+p'
-> (n+p)/(x(n'+p'))=46,67/53,33=7:8
Vì n-p=4 -> n=4+p
-> (2p+4)/2xp'=7/8 -> 7xp'-8p=16
Tổng số proton =p+xp'=58 -> p=26; xp'=32
Vì A là phi kim thuộc chu kì 3 nên 15 <= p' <=17 (P; S; Cl)
Với x=2 -> p'=16
Vậy M là Fe; A là S công thức là FeS2
1.2
cho vào lượng dư dung dịch BaCl2
MgSO4+BaCl2=>BaSO4+MgCl2
lọc bỏ kết tủa tiếp tục cho vào lượng dư Na2CO3
MgCl2+Na2CO3=>MgCO3+2NaCl
BaCl2+Na2CO3=>BaCO3+2NaCl
CaCl2+Na2CO3=>CaCO3+2NaCl
lọc bỏ kết tủa, dung dịch gồm NaCl Na2CO3 dư
cho HCl dư vào
2HCl+Na2CO3=>2NaCl+H2O+CO2
đun nhẹ dung dịch cho HCl dư bay hơi cô cạn dung dịch thu được NaCl tinh khiết
Chọn đáp án D.
- Y là phi kim thuộc chu kỳ 3, có công thức oxit cao nhất là YO3 → Y là S (lưu huỳnh).
- Ta có: %M = M/(M+32) = 66,67% →M = 64 (Cu)