Dung dịch (A) chứa a mol Ba(OH)2 và m gam NaOH. Sục từ từ CO2 đến dư vào dung dịch (A) thấy lượng kết tủa biến đổi theo đồ thị dưới đây: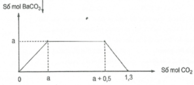
Giá trị của a và m lần lượt là
A. 0,4 và 40,0
B. 0,4 và 20,0
C. 0,5 và 24,0.
D. 0,5 và 20,0.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Từ đồ thị ta thấy:
(1) Đoạn đi lên: Ba(OH)2 + CO2 → BaCO3↓ + H2O
(2) Đoạn ngang: 2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + CO2 + H2O → NaHCO3
(3) Đoạn đi xuống: BaCO3 + CO2 + H2O → Ba(HCO3)2
Xét (2) => nCO2 = nNaOH = 0,5 (mol) => m = 20 (g)
Tổng số mol CO2 phản ứng là 1,3 mol = nNaOH + 2nBa(OH)2
=> nBa(OH)2 = 0,4 mol = a
Vậy a = 0,4 và m = 20
Đáp án C

Đáp án C
Ta có nOH– = 2a + m 40
Khi kết tủa tan hết thì chỉ có muối hidrocacbonat tức là lượng CO2 phản ứng cũng chính bằng số mol OH–.
⇒ 2a + m 40 = 1,3.
Khi lượng kết tủa bắt đầu giảm tức là CO2 đã phản ứng với OH– tạo a mol BaCO3 và còn lại là muối hirdocacbonat.
nCO2 = a + 0,5 = nBaCO3 + nNaHCO3 = a + m 40 ⇒ m = 20.
⇒ a = 0,4
Đáp án B
Gọi số mol của Ba(OH)2 và NaOH lần lượt là a, b.
Nhận thấy tại 1,3 mol CO2 thì kết tủa bị hòa tan hoàn toàn
Tại (a + 0,5) mol CO2 thì kết tủa là a mol và lúc này xảy ra hiện tượng hòa tan kết tủa