hòa tan 7.2g dung dịch kiềm thổ(nhóm IIA)vào dung dịch HCL 0.5Mvừa đủ thu đc khí Xdẫn khí X qua fe2o3 dư đun nóngthu dc 11.2 g dắt kim loại
a) xác định tên kim loại
b) tính thể tích dd HCl đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

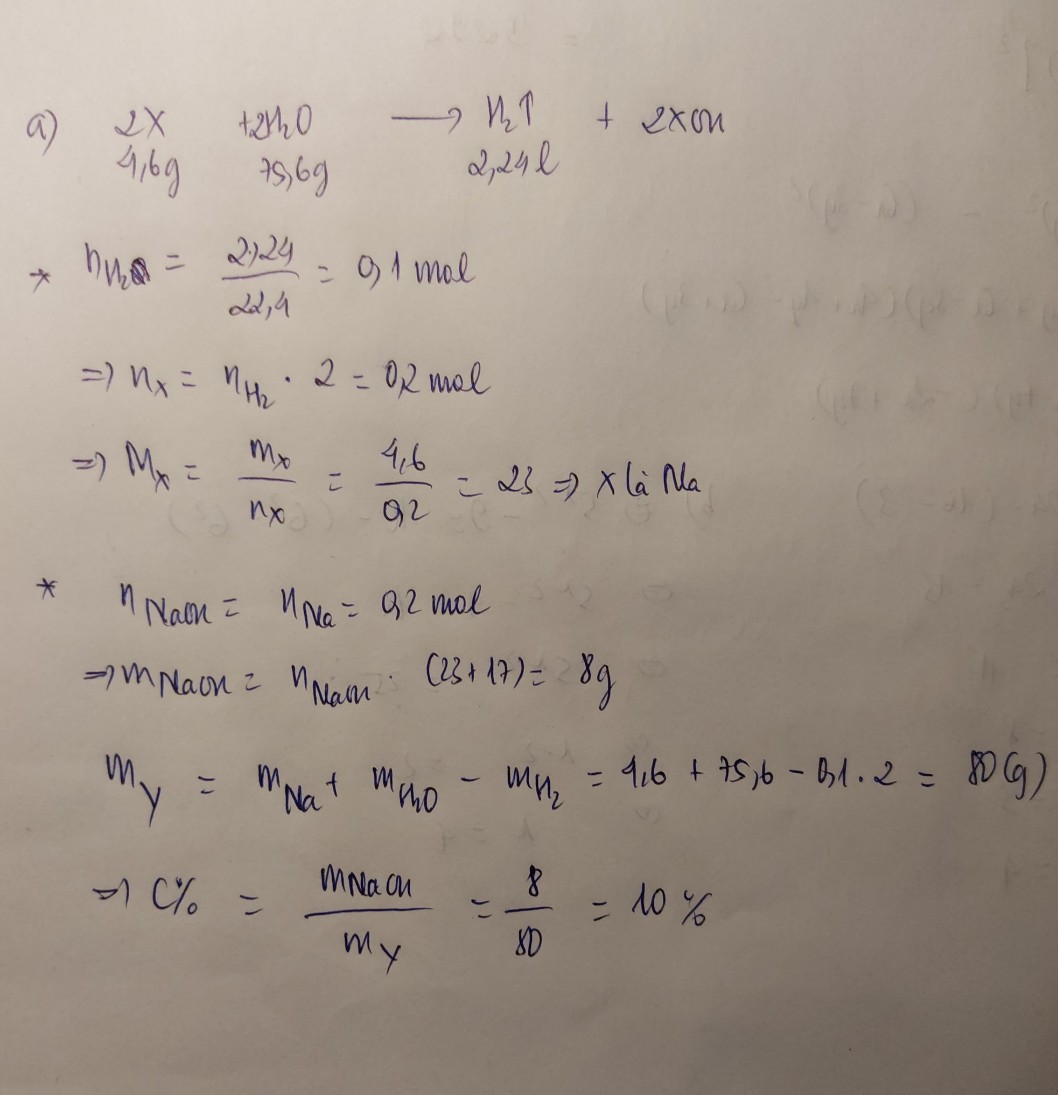


a) \(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
2A + 2HCl --> 2ACl + H2
2B + 2HCl --> 2BCl2 + H2
=> nA + nB = 2.nH2 = 0,16
=> \(\overline{M}_{hh}=\dfrac{4,8}{0,16}=30\)
Mà A, B thuộc 2 chu kì liên tiếp nhóm IA
=> A, B là Na, K
b)
Gọi số mol Na, K là a,b
=> 23a + 39b = 4,8
2Na + 2HCl --> 2NaCl + H2
_a----->a-------------->0,5a
2K + 2HCl --> 2KCl + H2
_b--->b-------------->0,5b
=> 0,5a + 0,5b = 0,08
=> a = 0,09; b = 0,07
nHCl(PTHH) = a + b = 0,16
=> nHCl(thực tế) = 0,16.125% = 0,2(mol)
=> \(V_{ddHCl}=\dfrac{0,2}{1}=0,2\left(l\right)\)

C2:
PTHH: 2Al+6HCl →2AlCl3 +3H2
a)
Ta có:
\(+n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(+n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Biện luận:
\(\dfrac{0,3}{2}>\dfrac{0,6}{6}\)
⇒Al dư, HCl pư hết.
\(+n_{Al}\)dư =0,3-0,2=0,1(mol
\(+m_{Al}\)dư =0,1.27=2,7(gam)
b)
\(+n_{AlCl_3}=0,2\left(mol\right)\)
⇒\(m_{AlCl_3}=0,2.133,5=26,7\left(gam\right)\)
c) PTHH: H2+CuO→Cu+H2O
\(+n_{CuO}=n_{H_2}=0,3\left(mol\right)\)
\(+m_{CuO}=0,3.80=24\left(gam\right)\)
Chúc bạn học tốt.
\(1.\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2N+2nHCl\rightarrow2NCl_n+nH_2\)
\(\dfrac{0.5}{n}.....0.5...............0.25\)
\(M_N=\dfrac{16.25}{\dfrac{0.5}{n}}=32.5n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow N=65\)
\(Nlà:Zn\)
Không tính được thể tích vì thiếu nồng độ mol nhé.
\(2.\)
\(n_{Al}=\dfrac{8.1}{27}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{21.9}{36.5}=0.6\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.2........0.6..........0.2...........0.3\)
\(m_{Al\left(dư\right)}=\left(0.3-0.2\right)\cdot27=2.7\left(g\right)\)
\(m_{AlCl_3}=0.2\cdot133.5=26.7\left(g\right)\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.....0.3\)
\(m_{CuO}=0.3\cdot80=24\left(g\right)\)

a) X + HCl ------> XCl2 + H2
XCl2 + 2NaOH --------> 2NaCl + X(OH)2
Bảo toàn nguyên tố X
\(n_X=n_{X\left(OH\right)_2}\)
=> \(\dfrac{2,4}{X}=\dfrac{5,8}{X+17.2}\)
=> X=24 (Mg)
b) \(n_{HCl}=2n_{Mg}=0,2\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,2}{1}=0,2\left(l\right)\)

Giả sử KL R có hóa trị n.
PT: \(2R+2nHCl\rightarrow2RCl_n+nH_2\)
a, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
Theo ĐLBT KL, có: mR + mHCl = mRCln + mH2
⇒ mRCln = 13 + 0,4.36,5 - 0,2.2 = 27,2 (g)
b, Theo PT: \(n_R=\dfrac{2}{n}n_{H_2}=\dfrac{0,4}{n}\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{13}{\dfrac{0,4}{n}}=32,5n\)
Với n = 1 ⇒ MR = 32,5 (loại)
n = 2 ⇒ MR = 65 (nhận)
Vậy: R là kẽm (Zn).
c, Ta có: \(V_{HCl}=\dfrac{0,4}{0,2}=2\left(l\right)\)
d, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{64}{160}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,4}{3}\), ta được Fe2O3 dư.
Chất rắn sau pư gồm Fe và Fe2O3 dư.
Theo PT: \(n_{Fe_2O_3\left(pư\right)}=\dfrac{1}{3}n_{H_2}=\dfrac{2}{15}\left(mol\right)\) \(\Rightarrow n_{Fe_2O_3\left(dư\right)}=\dfrac{4}{15}\left(mol\right)\)
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{4}{15}\left(mol\right)\)
\(\Rightarrow m_{cr}=m_{Fe}+m_{Fe_2O_3\left(dư\right)}=\dfrac{4}{15}.56+\dfrac{4}{15}.160=57,6\left(g\right)\)
Bạn tham khảo nhé!

Gọi kim loại cần tìm là A
a) PTHH: \(A+H_2O\rightarrow AOH+\dfrac{1}{2}H_2\uparrow\)
\(AOH+HCl\rightarrow ACl+H_2O\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_A=0,2mol\)
\(\Rightarrow M_A=\dfrac{7,8}{0,2}=39\) \(\Rightarrow\) Kim loại cần tìm là Kali
b) Ta có: \(\left\{{}\begin{matrix}n_{KCl}=0,2mol\\n_{HCl\left(pư\right)}=0,2mol\Rightarrow n_{HCl\left(dư\right)}=0,2\cdot20\%=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{KCl}=0,2\cdot74,5=14,9\left(g\right)\\m_{HCl\left(dư\right)}=0,04\cdot36,5=1,46\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{H_2}=2\cdot0,1=0,2\left(g\right)\)
\(\Rightarrow m_{dd}=m_K+m_{ddHCl}-m_{H_2}=7,8+\dfrac{0,24\cdot36,5}{10\%}-0,2=95,2\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{KCl}=\dfrac{14,9}{95,2}\cdot100\%\approx15,65\%\\C\%_{HCl\left(dư\right)}=\dfrac{1,46}{95,2}\cdot100\%\approx1,53\%\end{matrix}\right.\)

Gọi M là khối lượng mol trung bình của 2 nguyên tố
nH2=6.72/22.4=0.3 mol
M + H2O --> MOH + 1/2 H2
0.6mol---------------------0.3mol
-> M=20.2/0.3=67.3333
-->M1<67.33<M2
mà 2 kim loại này thuộc hai chu kì liên tiếp nhau
--> Kim loại đó là KI và Rb