Nhỏ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3. Kết quả thí nghiệm được biểu diễn theo đồ thị. Giá trị của x (tính bằng mol) là: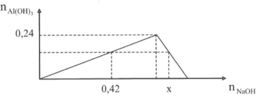
A. 0,66
B. 0,82.
C. 0,96.
D. 1,00.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
- Các phương trình phản ứng theo thứ tự:
3NaOH + AlCl3 → Al(OH)3 + 3NaCl (1)
NaOH + A1(OH)3 → NaAl(OH)4 (2)
Đặt a = n A l C l 3 . Từ các phương trình phản ứng, ta có:
+ Phản ứng (1):
n N a O H = 3 n A l C l 3 = 3 a ; n A l O H 3 = n A l C l 3 = a
+ Phản ứng (2):
n n a O H = 3 n A l O H 3 = a
- Các điểm đặc biệt:
+ Chưa phản ứng: (0; 0).
+ Phản ứng (1) hết: (3a; a).
+ Phản ứng (2) hết: (4a; 0).
⇒ a = 0,24; 3a = 0,72; 4a = 0,96.
- Sử dụng tính chất đồng dạng của các tam giác thích hợp, tính được: x = 0,82.

Giải thích:
Cho từ từ đến dư NaOH vào AlCl3 ta có:
Kết tủa cực đại khi tất cả Al3+ chuyển thành Al(OH)3
Từ đồ thị: nAl(OH)3 max = 0,24 (mol) => nAl3+ ban đầu = 0,24 (mol)
+ nOH- = 0,42 mol => chỉ tạo kết tủa Al(OH)3. Khi đó nAl(OH)3 = 1/3nOH- = 1/3. 0,42 = 0,14 (mol) (1)
+ nOH- = x mol => tạo kết tủa Al(OH)3 cực đại sau đó kết tủa Al(OH)3 tan dần đến khi còn lại đúng 1 lượng như ở (1)
Al3+ + 3OH- → Al(OH)3↓
0,14← 0,42 ← 0,14
Al3+ + 4OH- → AlO2- + H2O
(0,24- 0,14)→ 0,4
∑ nOH- = 0,42 + 0,4 = 0,82 (mol)
Đáp án A

Đáp án A
Ta nhận thấy đồ thị có 2 giai đoạn:
+ Giai đoạn kết tủa tăng do AlCl3 tác dụng với NaOH tạo kểt tủa Al(OH)3.
+ Giai đoạn kết tủa giảm do Al(OH)3 tác dụng với NaOH dư hòa tan kết tủa.
Nhận thấy lúc ta thêm x mol NaOH thì thu được lượng kết tủa tương đương với lúc tăng kết tủa khí NaOH là 0,42 tức lúc này thu được 0,14 mol kết tủa.
Giai đoạn x mol kết tủa giảm chứng tỏ kết tủa có bị hòa tan đi 0,1 mol (so với cực đại 0,24 mol). x=0,1+0,24.3=0,82 mol

Đáp án A
Ta nhận thấy đồ thị có 2 giai đoạn:
+ Giai đoạn kết tủa tăng do AlCl3 tác dụng với NaOH tạo kểt tủa Al(OH)3.
+ Giai đoạn kết tủa giảm do Al(OH)3 tác dụng với NaOH dư hòa tan kết tủa.
Nhận thấy lúc ta thêm x mol NaOH thì thu được lượng kết tủa tương đương với lúc tăng kết tủa khí NaOH là 0,42 tức lúc này thu được 0,14 mol kết tủa.
Giai đoạn x mol kết tủa giảm chứng tỏ kết tủa có bị hòa tan đi 0,1 mol (so với cực đại 0,24 mol).
x=0,1+0,24.3=0,82 mol

ĐÁP ÁN A
Tại nAl(OH)3 = 0,24 mol thu lượng kết tủa đạt lớn nhất => n Al3+ = 0,24 mol
Tại nNaOH= 0,42 mol
=> Al3+ dư => n kết tủa = nOH- =0,14 mol
lượng kết tủa như nhau
Tại nNaOH = x mol
=> n kết tủa = 4n Al3+ - nOH-
=> x= 0,82 mol => chọn A

Chọn đáp án D.
x = 0,6 mol thì kết tủa cực đại
⇒ 3 n F e C l 3 + 3 n A l C l 3 = 0 , 6 m o l
x = 0,74 mol thì kết tủa bị hòa tan nhiều nhất
⇒ n A l ( O H ) 3 = 0 , 74 - 0 , 6 = 0 , 14 m o l ⇒ n A l C l 3 = 0 , 14 m o l , n F e C L 3 = 0 , 06 m o l
x = 0,66 mol thì kết tủa bị hòa tan một phần:
n A l ( O H ) 3 b ị h ò a tan = 0 , 66 - 0 , 6 = 0 , 06 m o l ⇒ m = m A l ( O H ) 3 d ư + m F e ( O H ) 3 = 78 ( 0 , 14 - 0 , 06 ) + 107 . 0 , 06 = 12 , 66 g a m
Chọn B.
- Các phương trình phản ứng theo thứ tự:
3NaOH + AlCl3 → Al(OH)3 + 3NaCl (1)
NaOH + A1(OH)3 → NaAl(OH)4 (2)
Đặt a = n A l C l 3 . Từ các phương trình phản ứng, ta có:
+ Phản ứng (1): n N a O H = 3 n A l C l 3 = 3 a ; n A l ( O H ) 3 = n A l C l 3 = a
+ Phản ứng (2): n N a O H = 3 n A l ( O H ) 3 = a
- Các điểm đặc biệt:
+ Chưa phản ứng: (0; 0).
+ Phản ứng (1) hết: (3a; a).
+ Phản ứng (2) hết: (4a; 0).
=> a = 0,24; 3a = 0,72; 4a = 0,96.
- Sử dụng tính chất đồng dạng của các tam giác thích hợp, tính được: x = 0,82.