Cho 27,6 gam hợp chất thơm X có CT C7H6O3 tác dụng với 800 ml dd NaOH 1M được dd Y. Trung hòa Y cần 100 ml dd H2SO4 1M được dd Z. Khối lượng chất rắn thu được khi cô cạn dd Z là
A. 31,1 gam.
B. 56,9 gam.
C. 58,6 gam.
D. 62,2 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNaOH = 0,2mol
n H 2 S O 4 ( t r u n g h ò a ) = 0,02mol
nx = 9,12/152 = 0,06 mol => nNaOH(p/u với X) = 0,2 − 0,01.2 = 0,18 mol
−NX: nNaOH = 3nX
=> CTCTX: RCOO−C6H4(R′)−OH
Với R +R' = CH3
RCOO−C6H4(R′)−OH  RCOONa + C6H4(R′)(ONa)2 + 2H2O
RCOONa + C6H4(R′)(ONa)2 + 2H2O
2NaOH +H2SO4 → Na2SO4 + 2H2O
=> nH2O = 2nX + 2 nNaOH dư = 2. 0,06 + 0,01.2 =0,14
Bảo toàn khối lượng cho cả 2 quá trình:
mX + mNaOH + mH2SO4 = mrắn + mH2O
=> mrắn = 15,58 gam
Đáp án cần chọn là: C

Đáp án C
![]()
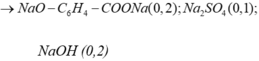
Khối lượng chất rắn khan thu được khi cô cạn dung dịch Z là
![]()

Có nNaOH = 0,8 mol ; nH2SO4 trung hòa = 0,1 mol
=>nNaOH phản ứng với X = 0,8 – 0,1.2 = 0,6 mol = 3nX
=>X phải có CT là HCOO-C6H4-OH
=>Chất rắn sau cô cạn có : 0,1 mol Na2SO4 ; 0,2 mol HCOONa ; 0,2 mol C6H4(ONa)2
=>m = 58,6g
=>C

Đáp án D
Ta có: nAxit glutamic = 0,09 mol, nHCl = 0,2 mol
⇒ ∑nCOOH + H+ = 0,09×2 + 0,2 = 0,38 mol.
+ nNaOH = 0,34 mol < ∑nCOOH + H+ = 0,38 mol ⇒ nH2O tạo thành = 0,38 mol.
Bảo toàn khối lượng ta có:
mChất rắn = 13,23 + 0,2×36,5 + 0,4×40 – 0,38×18 = 29,69 gam

Đáp án B
Áp dụng định luật bảo toàn khối lượng có
mX + mddNa/KOH = m chất rắn + mH2O sản phẩm
⇒ mH2O sản phẩm = 16,4 + 0,2. ( 40 + 56) – 31,1 = 4,5
⇒ nH2O sản phẩm = 0,25 < nNaOH + nKOH
⇒ nAxit = nH2O sản phẩm = 0,25 ( dựa vào đáp án thì các Axit đều đơn chức)
⇒ MX = 16,4 : 0,25 = 65,6
Mà 2 Axit đồng đẳng kế tiếp ⇒ 2Axit đó là C2H4O2 và C3H6O2.