Làm thí nghiệm người ta thấy bình chứa 1kg khí nitơ bị nổ ở nhiệt độ 350 ° C. Tính khối lượng khí hiđrô có thế chứa trong bình cùng loại nếu nhiệt độ tối đa bị nổ là 50 ° C và hệ số an toàn là 5, nghĩa là áp suất tối đa chỉ bằng 1/5 áp suất gây nổ. Cho H = 1; N = 14; R = 8,31J/mol.K.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi V là thể tích của bình và pn là áp suất gây nổ.
Đối với khí nitơ ta có: p n V = m N μ N R T N (1)
Đối với khí hiđrô ta có: p n 5 V = m H μ H R T H (2)
Từ (1) và (2) ⇒ m H = m N . T N . μ H 5. T H . μ N = 27 , 55 g

Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn: { V 1 = m p = 3 , 96 1 , 98 m 3 = 2 m 3 p 1 = p 0 = 1 a t T 1 = 0 0 C = 273 K
Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ { V 2 = 0 , 04 m 3 p 2 = 60 a t T 2 = ?
Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ T 2 = p 2 V 2 T 1 p 1 V 1 = 60.0 , 04.273 1.2 T 2 = 327 , 6 K
Mà T 2 = 273 + t 2 = 327 , 6 K ⇒ t 2 = 54 , 6 0 C

+ Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn:
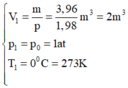
+ Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ:


Đáp án C
Gọi P o và T o lần lượt là áp suất và nhiệt độ ban đầu của khối khí trong bình
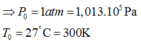
Gọi P và T lần lượt là áp suất và nhiệt độ của khối khí trong bình khi nút bắt đầu bị đẩy lên
![]()
Vì thể tích của khối khí là không thay đổi ngay trước khi nút bị đẩy lên, do đó theo định luật Sác – lơ, ta có:
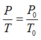

![]()
khi nút bắt đầu bị đẩy lên, ta có:
![]()

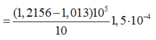
![]()

Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
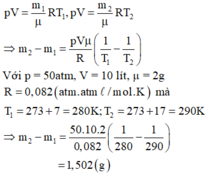

Chọn D.
Áp dụng phương trình Cla-pê-rôn – Men-đê-lê-ép:
+ Trạng thái 1 (khi chưa tăng nhiệt độ):
Khối lượng m1, p1 = 5.105 Pa, V1 = 4,8 lít, T1 = 287 K
Từ phương trình:
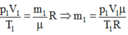
+ Trạng thái 2 (khi đã tăng nhiệt độ):
Khối lượng m2, p2 = p1 = 5.105 Pa, V2 = V1 = 4,8 lít, T2 = 26 + 273 = 287 K.
Từ phương trình:
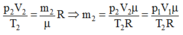
Khối lượng khí thoát ra ngoài:
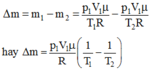
Thay số:
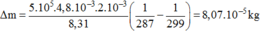

Gọi m1, m2 là khối lượng khí trong bình trước và sau khi nung nóng bình. Áp dụng phương trình Menđêlêep – Clapêrôn ta có:
p V = m 1 μ R T 1 , p V = m 2 μ R T 2 . ⇒ m 2 − m 1 = p V μ R ( 1 T 1 − 1 T 2 )
Với p = 50atm, V = 10 lít, μ = 2 g
R = 0 , 082 ( a t m . l / m o l . K ) Mà T 1 = 273 + 7 = 280 K ; T 2 = 273 + 17 = 290 K
⇒ m 2 − m 1 = 50.10.2 0 , 082 ( 1 280 − 1 290 ) m 2 - m 1 = 1 , 502 ( g )

\(V_{O_2\left(thu.được\right)}=28=0,1=2,8\left(l\right)\)
=> \(V_{O_2\left(sinh.ra\right)}=\dfrac{2,8.100}{80}=3,5\left(l\right)\)
=> \(n_{O_2\left(sinh.ra\right)}=\dfrac{3,5}{22,4}=0,15625\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3125<------------------------0,15625
=> mKMnO4 = 0,3125.158 = 49,375 (g)

+ Gọi V là thể tích của bình và p n là áp suất gây nổ.
+ Đối với khí nitơ ta có: