Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 thu được hỗn hợp gồm 2 sản phẩm khử gồm 0,03 mol N2 và 0,02 mol NO. Tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khôi lương muôi nitrat kim loai = 6 + 0,02 x 8 x 62 + 0,02 x 3 x 62 = 19,64 gam
-> m NH4NO3 = 25,4 - 19,64 = 5,76 gam
-> n NH4NO3 = 5,76/80 = 0,072 mol
-> n HNO3 bị khử = 2n N2O + n NO + n NH4NO3 = 0,132
=> Đáp án D

Hỗn hợp Z gồm CO và CO2 có M = 36 dùng đường chéo ⇒ CO = CO2 = 0,03 mol
nO phản ứng = CO = 0,03 mol
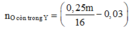
Khối lượng kim loại trong Y: 0,75m.
n N O 3 - tạo muối = 0,04.3 = 0,12 mol
![]()
⇒ m = 9,477
⇒Chọn C

Số mol Al là: ![]()
Trộn Al và X không có phản ứng hóa học xảy ra ![]()
*Xét giai đoạn dung dịch Z tác dụng với AgNO3 dư:
Dung dịch Z tác dụng với AgNO3 thu được khí NO => Z chứa Fe2+ và H+ (*)
Z chứa Fe2+ và H+ => Z không chứa N O 3 - (**)
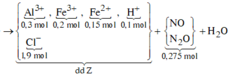
Từ (*) và (**) => Dung dịch Z gồm: ![]()
Các phản ứng tạo kết tủa:
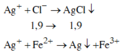
=> Kết tủa: 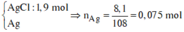
Các quá trình nhường, nhận electron:
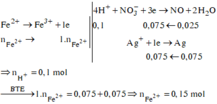
![]()
![]()
![]()
![]()
*Xét giai đoạn Y tác dụng với dung dịch HCl, HNO3:
Sơ đồ phản ứng:
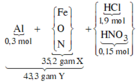
![]()
![]()
![]()
![]()
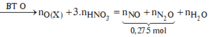
![]()
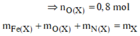
![]()
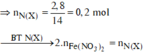
![]()
![]()
Đáp án B.

Đáp án A
Khí X có chứa H2 à dung dịch X không có muố nitrat;
Sau phản ứng thu được hỗn hợp kim loại à Mg dư à H+ đã phản ứng hết
Số mol H+ phản ứng = 0,4 (mol); Số mol H+ tạo ra H2 và N2 = 0,3 à có muối amoni trong dung dịch X
Số mol NH4+ = 0 , 4 - 0 , 3 10 = 0 , 01 (mol)à Số mol Cu(NO3)2 (bđ) = 0,025 (mol)
Theo bảo toàn e à số mol Mg phản ứng = 0,195 (mol); khố lượng Mg dư = 0,4 gam
à Khối lượng Mg (ban đầu) = 5,08 gam
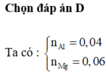
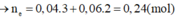
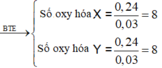
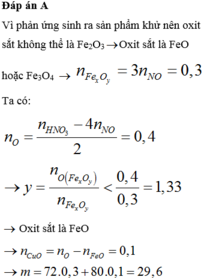

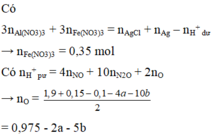
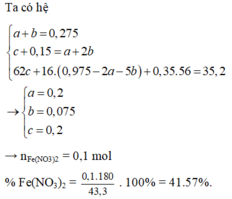
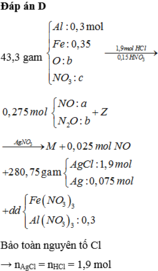

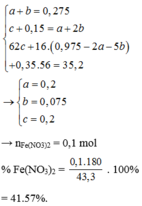
Sự thay đổi e:
\(Al^0\rightarrow Al^{+3}+3e\)
\(2N^{+5}+10e\rightarrow2N^0\)
\(N^{+5}+3e\rightarrow N^{+2}\)
Có: Số mol e nhường = số mol e nhận
\(\Leftrightarrow3.n_{Al}=10.n_{N_2}+3.n_{NO}\)
\(\Leftrightarrow3.n_{Al}=10.0,03+0,02.3\)
\(\rightarrow n_{Al}=0,12mol\)
Khối lượng của Al là: \(m_{Al}=0,12.27=3,24g\)