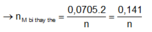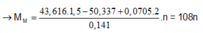Cho 1 lít dung dịch C u C l 2 0,1M. Điện phân với cường độ 10A trong vòng 2895s. Khối lượng Cu thoát ra là
A. 6,4 gam
B. 3,2 gam
C. 9,6 gam
D. 4,8 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Số mol electron trao đổi là : \(\frac{10.2895}{96500}=0,3\left(mol\right)\)
\(n_{Cu^{2+}}=n_{CuCl2}=0,1.1=0,1\left(mol\right)\)
Vì \(n_e>2n_{CuCl2}\)nên Cu2+ hết
\(n_{Cu}=n_{CuCl2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,1.64=6,4\left(g\right)\)

Đáp án C.
nCu = 0,12 mol.
nCu(NO3)2 = nCu = 0,12 mol.
mCu(NO3)2 = 0,12 x 188 = 22,56.

Đáp án C
Nhận thấy khối lượng dung dịch giảm không tỉ lệ với thời gian, ở anot luôn thu được O2 do vậy khối lượng chênh lệch là do Mn+ hết và bị thay thế bằng quá trình điện phân H2O tạo H2.
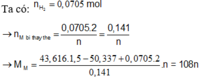
thỏa mãn n=1 thì M là Ag
Tại thời gian t giây gọi số mol Ag bị điện phân là x, suy ra n O 2 = 0 , 25 x
→ 108x+32.0,25x = 43,616 → x = 0,376
→ n A g N O 3 = 0,376.1,5 - 0,0705.2 = 0,423
→ m = 71,91 gam

Đáp án C
Nhận thấy khối lượng dung dịch giảm không tỉ lệ với thời gian, ở anot luôn thu được O2 do vậy khối lượng chênh lệch là do Mn+ hết và bị thay thế bằng quá trình điện phân H2O tạo H2.
Ta có: n H 2 = 0 , 0705 m o l