Cho 0,42 gam hỗn hợp bột Fe và Al vào 250 ml dung dịch A g N O 3 0,12M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 3,333 gam chất rắn. Khối lượng Fe trong hỗn hợp ban đầu là
A. 0,084 gam
B. 0,150 gam
C. 0,177 gam
D. 0,168 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C
GIẢ SỬ Ag+ bị “đẩy” ra hết ![]()
=> chất rắn sau phản ứng chứa Fe dư. Đặt n F e phản ứng = x, n A l = y
4Fe dư => X chứa ![]()
![]()
Bảo toàn khối lượng gốc kim loại: 0,42 + 0,03 x 108 = 56x + 27y = 3,333
=> Giải hệ có: x = 0,0015 mol; y = 0,009 mol; ![]()
=> Chọn C

Đáp án C
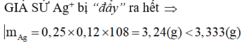
=> chất rắn sau phản ứng chứa Fe dư. Đặt
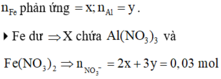
Bảo toàn khối lượng gốc kim loại:
![]()
=> giải hệ có: x = 0,0015 mol; y = 0,009 mol
![]()

còn TH: Al dư thì sao, Fe chưa phản ứng, cái này làm sao giải nhanh đây

nAgNO3 = 0,12.0,25 = 0,03(mol)
PTHH: Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
_____0,015<-0,03-------------------->0,03
=> 56(x-0,015) + 0,03.108 = 3,3333
=> x = 0,01666 (mol)
=> m = 0,01666.56 = 0,93296(g)
\(Fe + 2AgNO_3 \rightarrow Fe(NO_3)_2 + 2Ag\)
Ta có:
\(n_{AgNO_3}= 0,12 . 0,25=0,03 mol\)
Theo PTHH:
\(n_{Ag}=n_{AgNO_3}= 0,03 mol\)
\(\Rightarrow m_{Ag}= 0,03 . 108= 3,24 g < 3,333g\)\(\Rightarrow m_{Fe dư}= 3,333 - 3,24 =0,093 g\)
\(n_{Fe pư}= \dfrac{1}{2} n_{AgNO_3}= 0,015 mol\)
\(\Rightarrow m= m_{Fe dư} + m_{Fe pư}= 0,015 . 56 + 0,093=0,933 g\)