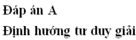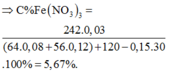Câu 4: Hòa tan 13,8 gam hỗn hợp Al và Fe bằng dung dịch HNO3 dư thu được 7,84 lít khí NO (đktc, là sản phẩm khử duy nhất) và dung dịch chứa m gam muối. a. Viết các phương trình hóa học xảy ra? b. Tính khối lượng mỗi kim loại trong hỗn hợp đầu. c. Tính m. Mn giải hộ e vs ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) PTHH: Al + 6 HNO3 -> Al(NO3)3 + 3 NO2 + 3 H2O
x___________6x________x________3x(mol)
Fe + 6 HNO3 -> Fe(NO3)3 + 3 NO2 + 3 H2O
y___6y______y____________3y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}27x+56y=1,95\\22,4.3x+22,4.3y=2,688\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,01\\y=0,03\end{matrix}\right.\)
b) Khối lượng mỗi kim loại trong hỗn hợp ban đầu:
mAl=27x=27 . 0,01=0,27(g)
mFe=56y= 56 . 0,03= 1,68(g)
c) m=m(muối)=mAl(NO3)3 + mFe(NO3)3= 213x+242y=213.0,01+ 242.0,03=9,39(g)

Đáp án: A
nNO= 0,01 mol=> nNO3-= 0,03 mol
m muối= m kim loại + m NO3- = 2+ 0,03.62= 3,86 gam

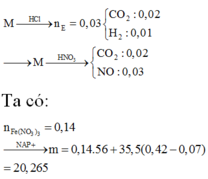
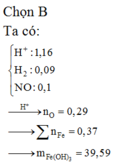
Đáp án A
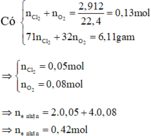
Y + HCl => Z chỉ chứa hai muối, HCl phản ứng hết
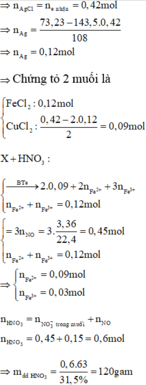
⇒ m dd T = 120 + 64 . 0 , 09 + 56 . 0 , 12 - 30 . 0 , 15 = 127 , 98 gam ⇒ C % Fe NO 3 3 = 242 . 0 , 03 127 , 98 . 100 % = 5 , 67 %
gần với giá trị 5% nhất

$n_{HNO_3} = 0,3.1 = 0,3(mol)$
$n_{NO_2} = \dfrac{1,12}{22,4} = 0,05(mol)$
$2H^+ + NO_3^- + 1e \to NO_2 + H_2O$
$n_{HNO_3\ pư} = n_{H^+} = 2n_{NO_2} = 0,1(mol)$
$\Rightarrow n_{HNO_3\ dư} = 0,3 - 0,1 = 0,2(mol)$
Gọi $V_{dd\ B} = x(lít) \Rightarrow n_{NaOH} = 0,01x(mol) ; n_{Ba(OH)_2} = 0,02x(mol)$
mà: $n_{HNO_3\ dư} = n_{NaOH} + 2n_{Ba(OH)_2}$
$\Rightarrow 0,2 = 0,01x + 0,02x.2$
$\Rightarrow x = 4(lít)$