Trộn 200 ml dung dịch chứa hỗn hợp HCl 0,1M và H2SO4 0,05M với 300 ml dung dịch Ba(OH)2 aM thu được m gam kết tủa và dung dịch có pH = 13. Giá trị của a và m là
A. 0,3 và 10,485
B. 0,3 và 2,33
C. 0,15 và 10,485
D. 0,15 và 2,33
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 15 :
$n_{HCl} = 0,2.0,1 = 0,02(mol)$
$n_{H_2SO_4} = 0,2.0,05 = 0,01(mol)$
$\Rightarrow n_{H^+} = 0,02 + 0,01.2 = 0,04(mol)$
$n_{OH^-\ dư} = 0,5.(10-14 : 10-13) = 0,05(mol)$
$H^+ + OH^- \to H_2O$
$n_{OH^-} = 0,04 + 0,05 = 0,09(mol)$
$n_{Ba(OH)_2} = \dfrac{1}{2}n_{OH^-} = 0,045(mol)$
$a = 0,045 : 0,3 = 0,15(M)$
$Ba^{2+} + SO_4^{2-} \to BaSO_4$
$n_{Ba^{2+}} = 0,045 > n_{SO_4^{2-}} = 0,01$ nên $Ba^{2+}$ dư
n BaSO4 = n SO4 = 0,01(mol)
=> m = 0,01.233 = 2,33(gam)
Đáp án A

Đáp án B
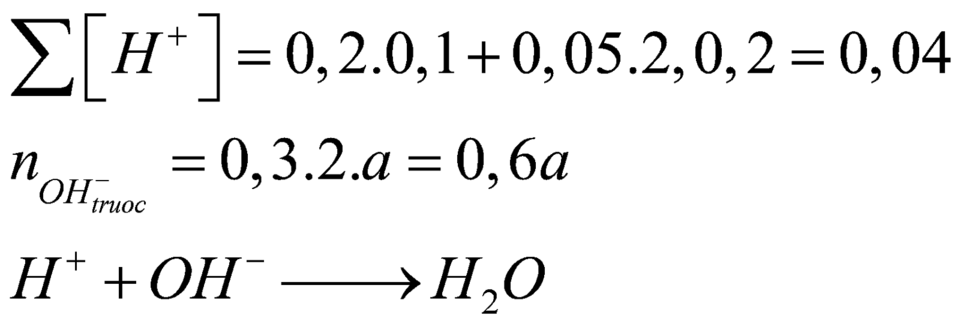
Mà sau phản ứng thu được dung dịch bazo có ph=13 (500ml)nên ta có
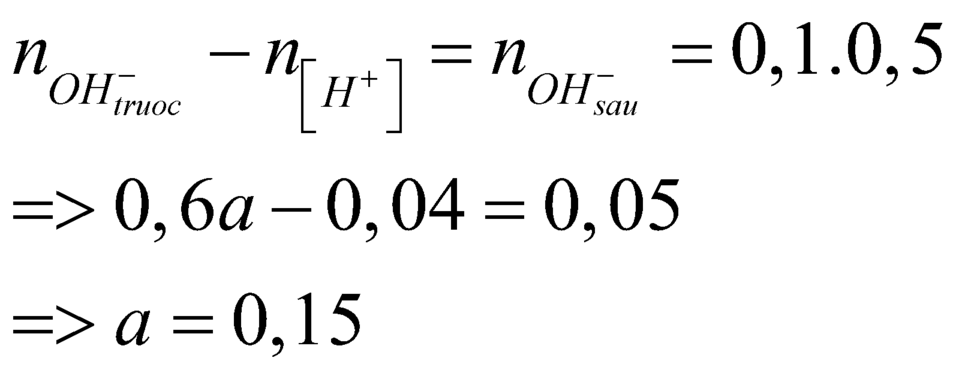
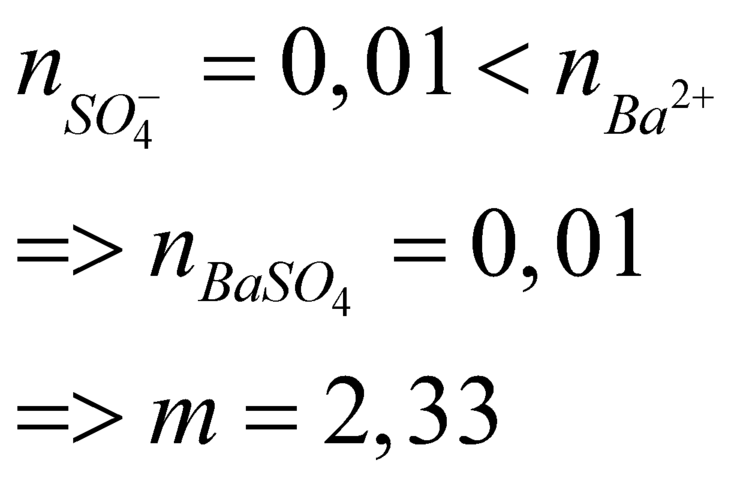

Đáp án B
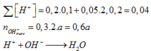
Mà sau phản ứng thu được dung dịch bazo có ph=13 (500ml)nên ta có
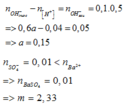

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`
Chọn đáp án D