Nguyên tử X có cấu hình electron ở lớp ngoài cùng là 3s1. Trong một nguyên tử X có tổng số hạt mang điện là
A. 9.
B. 11.
C. 18.
D. 22.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lớp ngoài 3s1 => Na => ô số 11, có 11e và 11p
=> 2 nguyên tư X có 22.2 =44
=> Đáp án C

1.Nguyên tử của nguyên tố X có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây không đ ng?
A. X có 4 electron ở lớp ngoài cùng.
B. X là phi kim.
C. X có 3 lớp electron.
D. Số hạt mang điện của nguyên tử X là 32
\(1s^22s^22p^63s^23p^4\) => Z= 16, có 6e lớp ngoài cùng
2. Nguyên tử R có cấu hình eletron: 1s22s22p63s23p5. Nhận xét nào dưới đây sai khi nói về R?
A. Số hiệu nguyên tử của R là 17 B. R có 3 lớp e
C. R có 5e ở lớp ngoài cùng. (3s23p5=>7e ngoài cùng) D. R là phi kim
3.Phát biểu nào dưới đây là ĐÚNG?
A. Electron ở phân lớp 4p có mức năng lượng thấp hơn electron ở phân lớp 4s.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Những electron ở lớp K có mức năng lượng thấp nhất.
(Theo trình tự sắp xếp lớp K là lớp gần hạt nhân nhất. Năng lượng của electron trên lớp K là thấp nhất.)
D. Các electron trong cùng một lớp có năng lượng bằng nhau.
4. Nhận định nào ĐÚNG?
A. Nguyên tố có số hiệu nguyên tử bằng 5 là nguyên tố kim loại.
B. Nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng thường là phi kim.
C. Các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng.
D. Tất cả các nguyên tố s đều là nguyên tố kim loại.
5. Số phân lớp, số obitan và số electron tối đa của lớp M lần lượt là
A. 3 ; 3 ; 6.
B. 3 ; 6 ; 12.
C. 3 ; 9 ; 18.
D. 4 ; 16 ; 18.
- Lớp M :3 phân lớp: 3s, 3p, 3d
- Phân lớp M chứa tối đa 18 electron
- Số obitan trong lớp e thứ n là n2 obitan =32 =9

Bài 1:
Ta có:p+e+n=116
Tức là :2p+n=116 (pt 1)
Số hạt mang điện trong ng tử là p và nên ta có p+e =2p
Số hạt không mang điện là n
Nên ta có 2p -n=24(pt2)
Từ 1,2 suy ra 2p+n=16
2p -n =24
Giải ra ta được:p=35,n=46
Số khối A=p+n =35+46=81
Ta có kí hiệu ngtu 81x35(xin lỗi mik ko ghi được)

B
Gọi số proton, nơtron và electron của X là p, n và e (trong đó p = e)
Theo bài ra ta có hệ phương trình:
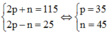
=> Cấu hình nguyên tử của X là
![]()

Ta có: P + N + E = 24
Mà: P = E (do nguyên tử trung hòa về điện)
⇒ 2P + N = 24 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 8.
⇒ 2P - N = 8 (2)
Từ (1) và (2) ⇒ P = E = N = 8
Cấu hình e: 1s22s22p4
→ Số e lớp ngoài cùng là 6.
Đáp án: A
Đây là nguyên tử oxygen nên số lớp electron ngoài cùng là 6
Chọn: A

Theo đề ra ta có hệ phương trình:
\(\left\{{}\begin{matrix}2p+n=52\\2p-n=12\end{matrix}\right.\)
Giải ra ta được p = 16 => Z = 16
Cấu hình electron nguyên tử: 1s22s22p63s23p4
Từ đây ta biết được: Nguyên tố thuộc chu kì 3, nhóm IVA
Vậy nguyên tố cần tìm là Sulfur.
Đáp án D
X : 1 s 2 2 s 2 s p 6 3 s 1 → p + e = 2 p = 22