Điện phân dung dịch AgNO3 với điện cực trơ một thời gian, thu được dung dịch X chứa 2 chất tan có cùng nồng độ mol và khối lượng dung dịch giảm 9,28 gam so với ban đầu. Cho tiếp 2,8 gam bột Fe vào dung dịch X, đun nóng khuấy đều thu được NO là sản phẩm khử duy nhất của N+5, dung dịch Y và chất rắn Z. Các phản ứng xảy ra hoàn toàn. Khối lượng muối tạo thành trong dung dịch Y là
A. 11,48 gam
B. 15,08 gam
C. 10,24 gam
D. 13,64 gam


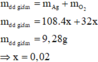
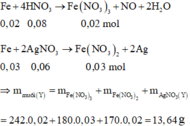
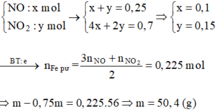

Chọn đáp án A
Dung dịch giảm 9,28 gam là do Ag2O →nAg2O = 0,04 mol → đọc ra nHNO3 trong X = 0,08 mol.
X chứa hai chất tan cùng nồng độ mol → X gồm 0,08 mol AgNO3 và 0,08 mol HNO3.
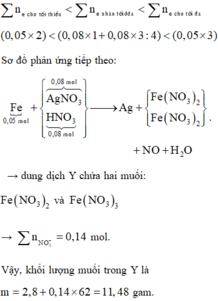
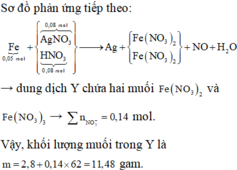
Phản ứng: 0,05 mol Fe tác dụng với 0,08 mol AgNO3 và 0,08 mol HNO3.
Các chất tham gia đều biết số lượng → cần tỉ lệ để xét xem các chất nào đủ dư hay như thế nào.
Quá trình nhận electron:
Ag+ + e →Ag
4H+ + NO3- + 3e →NO + 2H2O
→∑nelectron nhận tối đa = 0,14 mol.
Quá trình nhường electron:
Fe →Fe2+ + 2e
Fe →Fe3+ + 3e
→ 0,05x2 ≤ ∑nelectron nhường ≤ 0,05x3.
Nhận xét: 0,14 ϵ (0,1; 0,15) nên Fe phản ứng hết thu được cả muối Fe2+ và Fe3+.
« Xử lý nhanh: ∑nNO3-trong muối Fe = ∑ne cho nhận = 0,14 mol.
Suy ra yêu cầu: ∑mmuối trong dung dịch Y = 2,8 + 0,14 x 62 =11,48 gam