Đốt cháy hoàn toàn hỗn hợp X gồm hai hiđrocacbon kế tiếp nhau trong dãy đồng đẳng, thu được 4,48 lít khí CO2 (đktc) và 6,48 gam H2O. Hai hiđrocacbon trong X là
A. CH4 và C2H6
B. C2H6 và C3H8
C. C2H2 và C3H4
D. C2H4 và C3H6.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Vì n H 2 O = 0 , 36 > n C O 2 => dãy đồng đẳng ankan
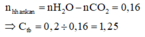

Chọn đáp án A
Vì
![]()
Dãy đồng đẳng ankan.
![]()
⇒ Ctrung bình = 0,2 ÷ 0,16 = 1,25
⇒ Chọn A

Đáp án B
TA có nCO2 = 0,1 mol; nH2O = 0,18 mol
Do nH2O > nCO2 nên 2 hiđrocAbon đồng đẳng kế tiếp là Ankan => Loại C và D
nAnkAn = nH2O – nCO2 = 0,08 mol => Số C trung bình = 0,1/0,08 = 1,25
=> 2 Ankan là CH4 và C2H6

Đáp án B
Đặt CTPT 2 ankan là C n ¯ H 2 n ¯ + 2
n C O 2 = 2 , 24 22 , 4 = 0 , 1 ( m o l ) ; n H 2 O = 3 , 24 22 , 4 = 0 , 18 ( m o l )
nx = n H 2 O - n C O 2 = 0,18 – 0,1 = 0,008 (mol)
=> 0,008 n ¯ = 0,1 => n ¯ = 1,25 => CTPT 2 ankan là: CH4 và C2H6

Ta có nCO2 = 0,1 mol; nH2O = 0,18 mol
Do nH2O > nCO2 nên 2 hiđrocAbon đồng đẳng kế tiếp là AnkAn=>Loại C và D
nAnkAn = nH2O – nCO2 = 0,08 mol
=>Số C trung bình = 0,1/0,08 = 1,25=>2 AnkAn là CH4 và C2H6
=>Chọn B.

$n_{CO_2} = \dfrac{11,2}{22,4} = 0,5(mol)$
$n_{H_2O} = \dfrac{14,4}{18} = 0,8(mol)$
$\Rightarrow$ Hai hidro cacbon có CTTQ là $C_nH_{2n+2}$
$n_{2\ hidrocacbon} = n_{H_2O} - n_{CO_2} = 0,3(mol)$
Suy ra số mol của 2 hidrocacbon lần lượt là 0,1 ; 0,2
Gọi số C của hai hidrocacbon là n , m
Bảo toàn C, ta có : $0,1n + 0,2m = 0,5$
Với n = 1 ; m = 2 thì thỏa mãn
Vậy hai hidrocacbon là $CH_4,C_2H_6$
Đáp án A
Bạn thiếu trường hợp nhé vì ở đây tỉ lệ 1:2 không rõ là CH4 với HĐC hay HĐC với CH4. Đáp án phải là D
Chọn đáp án A
Vì n H 2 O = 0 , 36 > n C O 2 ⇒ Dãy đồng đẳng ankan.
n hh ankan = n H 2 O - n CO 2 = 0 , 16
⇒ Ctrung bình = 0,2 ÷ 0,16 = 1,25
⇒ Chọn A