Chuẩn độ 20 ml dung dịch hỗn hợp HCl 0,1M + HNO3 a mol/l cần dùng hết 16,5 ml dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Giá trị của a là:
A. 0,07
B. 0,08
C. 0,065
D. 0,068
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
H+ + OH- → H2O
nOH- = 0,5 . 11.10-3 =5,5 . 10-3 mol
nH+ =nOH- = 5,5 . 10-3 mol
a= 5,5 . 10-3/ (20.10-3)=0,275 M

B1:
Cho dd NaOH vào hỗn hợp thì dd NaOH sẽ phản ứng với HCl trước sau đó mới phản ứng với muối AlCl3
Để kết tủa là cực đại <=> Không có quá trình hoà tan Al(OH)3
\(NaOH+HCl\rightarrow NaCl+H_2O\\ AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\\ n_{NaOH}=n_{HCl}+3.n_{AlCl_3}=0,01+0,02.3=0,07\left(mol\right)\\ \Rightarrow V_{ddNaOH}=\dfrac{n_{NaOH}}{C_{MddNaOH}}=\dfrac{0,07}{0,1}=0,7\left(lít\right)\)
2)
\(n_{Al_2\left(SO_4\right)_3}=0,0001.V\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,5.0,1=0,05\left(mol\right)\)
PTHH: \(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4+2Al\left(OH\right)_3\)
0,0003.V<--0,0001.V------>0,0003.V-->0,0002.V
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
(0,1-0,0006.V)<-(0,05-0,0003.V)
=> 233.0,0003.V + 78.(0,0008.V-0,1) = 12,045
=> V = 150 (ml)
3) \(n_{K_2SO_4.Al_2\left(SO_4\right)_3.24H_2O}=\dfrac{47,4}{948}=0,05\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{K_2SO_4}=0,05\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{Ba\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PTHH: \(3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4+2Al\left(OH\right)_3\)
0,15<-------0,05----------->0,15----->0,1
\(Ba\left(OH\right)_2+K_2SO_4\rightarrow BaSO_4+2KOH\)
0,05---------------------->0,05--->0,1
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
0,1--->0,1
=> mkt = mBaSO4 = 0,2.233 = 46,6(g)

Đáp án A

Ta có: ne cho = ne nhận = nH+
⇒ 0,02 + 0,4a = 0,19 → a = 0,425

Đáp án A.
Hướng dẫn :
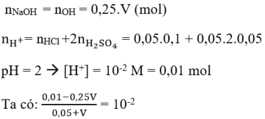
⇒ 0,01 - 0,25.V = 0,01.0,05 + 0,01 V à 0,26.V = 0,01 - 0,01.0,05
⇒ V = 0,0365 l = 36,5 ml

Đáp án D
Gọi x, y là số mol của Na2CO3 và K2SO4 trong hỗn hợp.
Phương trình phản ứng xảy ra:
Na2CO3 + 2HCl " 2NaCl + CO2 + H2O (1)
x 2x x
K2SO3 + 2HCl " 2KCl + SO2 + H2O (2)
y 2y y
2HCl + Ba(OH)2 " BaCl2 + 2H2O (3)
0,04 0,02
Theo đề bài ta có: 106x + 158y = 3,9 (I)
Mặt khác: 44 x + 16 y x + y = 33,586.16 => -13,328x + 6,672y = 0 (II)
ð x = 0,00925 mol; y = 0,0185 mol
ð %Na2CO3 = 0 , 00925 . 106 3 , 9 .100% = 25,14 à %K2SO3 = 74,86%

Đáp án C
![]()
nNaOH = 0,5.0,1 = 0,05 mol
n Ba(OH)2= 0,2.0,5 = 0,1 mol
⇒nOH- = 0,1.2 + 0,05 = 0,25 mol
nBa2+= 0,1 mol
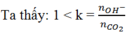
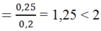
à tạo ra 2 ion CO32- và HCO3-
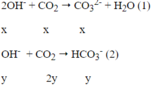
Ta có hệ phương trình:
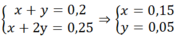
Ba2+ + CO32- " BaCO3↓
⇒mBaCO3= 0,05.197 = 9,85 g

Đáp án B
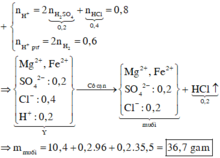
● Chú ý: Tiến hành cô cạn dung dịch chứa HCl, HNO3 thì các axit này sẽ bay hơi vì chúng có nhiệt độ sôi thấp.
Đáp án C.
Hướng dẫn: