Cho hỗn hợp gồm Mg và Al (tỉ lệ mol 1:1) tan vừa đủ trong dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với giá trị nào sau đây?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Vì hỗn hợp khí thu được có dY/H2 = 12,2 => Mkhí = 12,2.2 = 24,4
Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4) => khí còn lại có M < 24,4
=> Chỉ có thể là H2 => NO3- hết trước H+.
Ta có: nNO + nH2 = 0,125 mol (1)
Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2)
Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol
Bảo toàn nguyên tố N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có)
=> nNH4 = 0,05 mol
Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2 = 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol
Và: nMg = nAl (Đề bài)
=> nMg = nAl = 0,15 mol
Vậy dung dịch X chứa: 0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl-
Bảo toàn điện tích: nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol
=> m = åmion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g)

Đáp án : B
nMg : nAl = 1 : 3 = a : 3a
Ta có : mHCl : mH2SO4 = 7,3 : 9,8
=> nHCl : nH2SO4 = 2 : 1 = 2b : b
Bảo toàn điện tích : 2nMg + 3nAl = nCl + 2nSO4
=> 11a = 4b
mchất tan = mMg + mAl + mCl + mSO4 = 67,71g
=> 105a + 167b = 67,71
=> a = 0,12 ; b = 0,33 mol
=> nH2 =1/2 (nHCl +2nH2SO4) = 0,66 mol
=> VH2 = 14,784 lit

\(\text{Đ}\text{ặt}:n_{Mg}=a\left(mol\right);n_{Al}=1,5a\left(mol\right)\\ \Rightarrow24a+27.1,5a=12,9\\ \Leftrightarrow a=0,2\left(mol\right)\\\Rightarrow n_{Mg}=0,2\left(mol\right);n_{Al}=0,3\left(mol\right)\\ 2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ Mg+Cl_2\rightarrow\left(t^o\right)MgCl_2\\ n_{AlCl_3}=n_{Al}=0,3\left(mol\right);n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ m_{mu\text{ố}i}=m_{MgCl_2}+m_{AlCl_3}=95.0,2+0,3.133,5=59,05\left(g\right)\)
Đây là bài 1
B2:
\(n_{H_2}=0,4\left(mol\right)\\ n_{Cl_2}=0,45\left(mol\right)\\ \text{Đ}\text{ặt}:n_{Al}=x\left(mol\right);n_{Fe}=y\left(mol\right)\left(x,y>0\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ 2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ \Rightarrow\left\{{}\begin{matrix}1,5x+y=0,4\\1,5x+1,5y=0,45\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\\ \Rightarrow m=m_{Al}+m_{Fe}=27x+56y=27.0,2+56.0,1=11\left(g\right)\)

Đáp án C
nMg=nFe=9,6/(24+56)=0,12 mol
nO=nH+/2=0,36/2=0,18 mol => nO2=0,09 mol
nCl2=z
Giả sử trong Y:
Fe2+: x
Fe3+: y
Cl-: 2z+0,36 (BTNT Cl)
Fe2+ + Ag+ → Fe3+ + Ag
x x
Ag+ + Cl- → AgCl
2z+0,36 2z+0,36
BTNT Fe: x+y=0,12 (1)
BT e: 0,12.2+2x+3y=2z+0,18.2 (2)
m kết tủa = 108x+143,5(2z+0,36) = 85,035 (3)
Giải hệ pt ta được: x=0,03; y=0,09; z=0,105
%VO2=0,09/(0,09+0,105)=46,15%

Đáp án : D
Ta có : nFe : nCu : nAl : nMg =1 : 1 : 2 : 2
=> nFe = nCu = 0,1 ; nAl = nMg = 0,2 mol
4 khí trong đó N2 và NO2 có số mol bằng nhau
=> có thể qui về N2O và NO với số mol lần lượt là x và y
n N O 3 m u ố i K L = ne KL = 3nFe + 2nCu + 3nAl + 2nMg = 1,5 mol
=> mmuối = mKL + m N O 3 m u ố i K L + m N H 4 N O 3
=> n N H 4 N O 3 = 0,025 mol
Bảo toàn N :
2 n N 2 O + n N O + 2 n N H 4 N O 3 + n N O 3 m u ố i K L = n H N O 3
=> 2x + y = 0,35 mol
Bảo toàn e :
2 n N 2 O + n N O + 2 n N H 4 N O 3 + n N O 3 m u ố i K L = n H N O 3
=> 8x + 3y = 1,3
=> x = 0,125 ; y = 0,1 mol
=> V = 5,04 lit

Câu b) là tính nồng độ trong X chứ :v
a)
PTHH: Mg + 2HCl --> MgCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
Theo PTHH: \(n_{H_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.\left(0,4.2\right)=0,4\left(mol\right)\)
=> V = 0,4.22,4 = 8,96 (l)
b)
Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 7,8 (1)
Theo PTHH: nH2 = a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2(mol)
=> \(\left\{{}\begin{matrix}n_{MgCl_2}=0,1\left(mol\right)\\n_{AlCl_3}=0,2\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(AlCl_3\right)}=\dfrac{0,2}{0,4}=0,5M\\C_{M\left(MgCl_2\right)}=\dfrac{0,1}{0,4}=0,25M\end{matrix}\right.\)
Câu b) là tính nồng độ trong X chứ :v
a)
PTHH: Mg + 2HCl --> MgCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
Theo PTHH: nH2=12.nHCl=12.(0,4.2)=0,4(mol)nH2=12.nHCl=12.(0,4.2)=0,4(mol)
=> V = 0,4.22,4 = 8,96 (l)
b)
Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 7,8 (1)
Theo PTHH: nH2 = a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2(mol)
=> {nMgCl2=0,1(mol)nAlCl3=0,2(mol){nMgCl2=0,1(mol)nAlCl3=0,2(mol)
=> ⎧⎪ ⎪ ⎪⎨⎪ ⎪ ⎪⎩CM(AlCl3)=0,20,4=0,5MCM(MgCl2)=0,10,4=0,25M

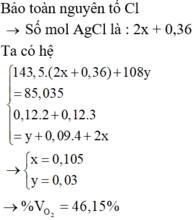
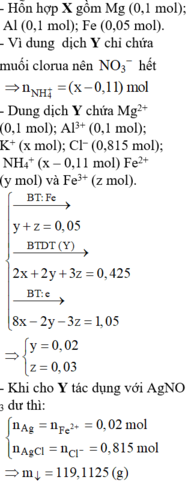
Đáp án D
Vì hỗn hợp khí thu được có dY/H2 = 12,2 => Mkhí = 12,2.2 = 24,4
Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4) => khí còn lại có M < 24,4
=> Chỉ có thể là H2 => NO3- hết trước H+.
Ta có: nNO + nH2 = 0,125 mol (1)
Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2)
Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol
Bảo toàn N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có)
=> nNH4 = 0,05 mol
Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2 = 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol
Và: nMg = nAl (Đề bài)
=> nMg = nAl = 0,15 mol
Vậy dung dịch X chứa: 0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl-
Bảo toàn điện tích: nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol
=> m = Smion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g)