Đốt 13,0 gam Zn trong bình chứa 0,15 mol khí Cl2, sau phản ứng hoàn toàn thu được chất rắn X. Cho X vào dung dịch AgNO3 dư thì thu được lượng kết tủa là ?
A. 46,30 gam
B. 57,10 gam
C. 53,85 gam
D. 43,05 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Zn + Cl_2 \xrightarrow{t^o} ZnCl_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 > n_{Cl_2} = 0,15\). Do đó.Zn dư
Zn + Cl2 \(\xrightarrow{t^o}\) ZnCl2
0,15.......0,15....0,15......................(mol)
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,05........................................... 0,1..........(mol)
ZnCl2 + 2AgNO3 → 2AgCl + Zn(NO3)2
0,15...............................0,3.........................(mol)
Vậy :
\(m_{kết\ tủa} = 0,1.108 + 0,3.143,5 = 53,85(gam)\)
\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+Cl_2\underrightarrow{t^0}ZnCl_2\)
\(0.15....0.15...0.15\)
\(\Rightarrow Zndư,Cl_2hết\)
\(ZnCl_2+2AgNO3\rightarrow Zn\left(NO_3\right)_2+2AgCl\)
\(0.15..................................................0.3\)
\(m_{AgCl}=0.3\cdot143.5=430.05\left(g\right)\)
Chúc bạn học tốt !!!

nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
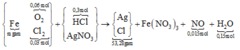
Ghép cụm có nH2O = nO trong oxit + 2nNO
→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa
→ về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
→ Yêu cầu m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án A

Đáp án A
Ta có nHCl cần dùng = 2∑nO trong oxit = 0,24 mol → ∑nHCl đã dùng (dư 25%) = 0,3 mol.
* Gộp cả quá trình có sơ đồ:
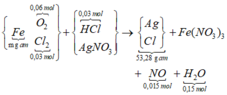
Ghép cụm NO3 bảo toàn O hoặc bảo toàn electron mở rộng ta có:
![]()
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về mặt nguyên tố ∑nAg trong tủa = 0,375 mol.
→ Bảo toàn nguyên tố N có
![]()
Theo đó, m gam Fe ban đầu tương ứng với 0,12 mol → m = 0,12 × 56 = 6,72 gam.

Đáp án A
nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
Sơ đồ phản ứng
{ Fe (m gam) + (O2 0,06 mol; Cl2 0,03 mol)} + (HCl: 0,3 mol; AgNO3)
→ (Ag-Cl : 53,28 gam) + Fe(NO3)3 + NO 0,015 mol) + H2O 0,15 mol)
Ta có nH2O = nO trong oxit + 2nNO ||→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
||→ m = mFe = 0,12 × 56 = 6,72 gam.
A:Vì
nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.Sơ đồ phản ứng
{ Fe (m gam) + (O2 0,06 mol; Cl2 0,03 mol)} + (HCl: 0,3 mol; AgNO3)
→ (Ag-Cl : 53,28 gam) + Fe(NO3)3 + NO 0,015 mol) + H2O 0,15 mol)
Ta có nH2O = nO trong oxit + 2nNO ||→ nNO = 0,015 mol.∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về nguyên tố nAg trong tủa = 0,375 molBảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.||→ m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án : C