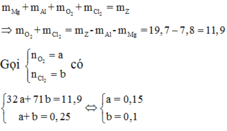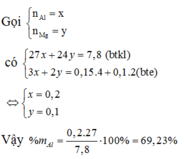Cho 3,164 gam hỗn hợp 2 muối CaCO 3 và BaCO 3 tác dụng với dung dịch HC1 dư, thu được 448 ml khí CO 2 (đktc) Tính thành phần % số mol của BaCO 3 trong hỗn hợp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
n khi = n CO 2 = 0,448/22,4 = 0,02 mol; n HCl = 0,02.2/1 = 0,04 mol
n Na 2 CO 3 = 0,02.1/1 = 0,02 (mol) → m Na 2 CO 3 = 0,02 x 106 = 2,12g
% m Na 2 CO 3 = 2,12/5 . 100% = 42,4%
% m NaCl = 100% - 42,4% = 57,6%

448ml = 0,448l
\(n_{CO2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
a) Pt : \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O|\)
1 2 2 1 1
0,02 0,02
b) \(n_{Na2CO3}=\dfrac{0,02.1}{1}=0,02\left(mol\right)\)
\(m_{Na2CO3}=0,02.106=2,12\left(g\right)\)
\(m_{NaCl}=5-2,12=2,88\left(g\right)\)
c) 0/0NaCl = \(\dfrac{2,88.100}{5}=57,6\)0/0
0/0Na2CO3 = \(\dfrac{2,12.100}{5}=42,4\)0/0
Chúc bạn học tốt

Đáp án A
Có
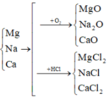
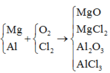
Vì các kim loại trong hỗn hợp X có hóa trị không đổi và khối lượng mỗi phần đều là 11 gam nên số mol electron trao đổi ở mỗi phần là như nhau.
Áp dụng định luật bảo toàn khối lượng ta có:
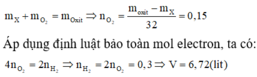

Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
n khi = n CO 2 = 0,448/22,4 = 0,02 mol; n HCl = 0,02.2/1 = 0,04 mol
n NaCl = 0,02.2/1 = 0,04 (mol) → m NaCl = 0,04 x 58,5 = 2,34g

Thành phần của hỗn hợp muối :
Theo phương trình hoá học, số mol CaCO 3 có trong hỗn hợp là
n CaCO 3 = n CO 2 = 0,02 mol
Khối lượng CaCO 3 có trong hỗn hợp là :
m CaCO 3 = 0,02 x 100 = 2 gam
Thành phần các chất trong hỗn hợp :
% m CaCO 3 = 2x100%/5 = 40%
% m CaSO 4 = 100% - 40% = 60%

Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
n khi = n CO 2 = 0,448/22,4 = 0,02 mol; n HCl = 0,02.2/1 = 0,04 mol
C M = n/V = 0,04/0,02 = 2M