Cho 5,1 gam hỗn hợp A gồm Mg, Al, Fe, Zn tác dụng với dung dịch HC1 vừa đủ thu được 3,136 lít khí (đktc). Tính tổng khối lượng muối thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
\(n_{HCl}=2.0,16=0,32\left(mol\right);n_{H_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
PTHH: Fe + 2HCl → FeCl2 + H2
\(m_{H_2}=0,16.2=0,32\left(g\right)\)
\(m_{HCl}=0,32.36,5=11,68\left(g\right)\)
Theo ĐLBTKL ta có: \(m_{MgCl_2+FeCl_2}=1,4+11,68-0,32=12,76\left(g\right)\)
Bài 12:
Theo ĐLBTKL, ta có:
\(m_{hhkl}+m_{O_2}=m_{hh.oxit}\\ \Leftrightarrow11,9+m_{O_2}=18,3\\ \Leftrightarrow m_{O_2}=18,3-11,9=6,4\left(g\right)\\ n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

a) Sửa đề: dd H2SO4 9,8%
Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\) \(\Rightarrow m_{H_2}=0,35\cdot2=0,7\left(g\right)\)
Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{H_2}=0,35\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,35\cdot98}{9,8\%}=350\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{H_2SO_4}-m_{H_2}=361,6\left(g\right)\)
b) Tương tự câu a

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)

Đáp án A
Tương tự Câu 12, áp dụng định luật bảo toàn mol electron ta có
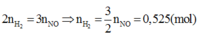
Vậy V= 11,76 (lít)

Đáp án A
Tương tự câu 12, áp dụng định luật bảo toàn mol electron ta có:
2 n H 2 = 3 n N O = > 3 2 n N O = 0 , 525 ( m o l )
Vậy V = 11,76 (lít)

Đáp án B
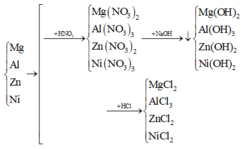
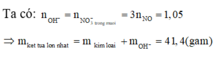
Khối lượng hỗn hợp mỗi phần là 23,55 gam.
Vì để thu được khối lượng kết tủa là lớn nhất nên không có sự hòa tan kết tủa bởi NaOH dư.
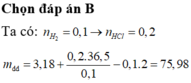
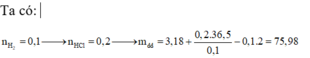
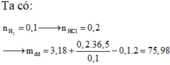
Nhận thấy : n HCl = 2 n H 2 = 2 x 3,136/22,4 = 0,28 mol
Theo định luật bảo toàn khối lượng có :
Khối lượng muối = 5,1 + 0,28.36,5 - 0,14.2 = 15,04 (gam)