Trộn 80 ml dung dịch HCl 0,03M với 50 ml dung dịch H 2 SO 4 0,02M thu được dung dịch có pH = x. Giá trị của x gần nhất với giá trị nào sau đây?
A. 1,6.
B. 1,5.
C. 2,0.
D. 1,8.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C

Chọn C
Số mol Ba ( OH ) 2 = 0,2.0,01 = 0,002 mol; Số mol KOH = 0,2.0,03 = 0,006 mol
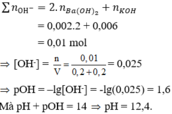

Đáp án : D
nH+ = nHCl + 2nH2SO4 = 0,1 mol
Dung dịch sau có pH = 13 => COH- = 0,1M => nOH- = 0,04 mol
=> nOH (Y) = 0,14 mol = ånKL.(số điện tích)
Lại có : 2nH2 = nOH ( do các kim loại tạo ra) = 0,14 mol với 400 ml Y
=> Với 200 ml dung dịch Y có nOH tạo ra do kim loại = 0,07 mol
=> nOH tạo ra do oxit = 0,07 mol = ånKL(oxit).(số điện tích) = 2nO (bảo toàn điện tích)
=> nO = 0,035 mol
Để tạo 400 ml Y thì nO = 0,035.2 = 0,07 mol
=> m = 12,8g
Chọn B