Trong phản ứng: Al + HNO3 (loãng) → Al(NO3)3 + N2O + H2O, tỉ lệ giữa số nguyên tử Al bị oxi hoá và số phân tử HNO3 bị khử (các số nguyên, tối giản) là
A. 8 và 30
B. 4 và 15
C. 8 và 6
D. 4 và 3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
Số phân tử bị khử chính bằng số phân tử N2O
8Al + 30HNO3 à 8Al(NO3)3 + 3N2O + 15H2O

Đáp án : B
(3x + 8y) Al -> Al3+ + 3e
3 (x + 2y)N5+ + (3x + 8y) -> xN2+ + 2yN1+
=> số phân tử HNO3 bị khử = số N trong sản phẩm khử = 3(x + 2y) = 3x + 6y

Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Số phân tử HNO3 bị khử thành NO là 1; số phân tử HNO3 tạo muối Al(NO3)3 là 3 ⇒ Chọn A.

Đáp án A
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Số phân tử HNO3 bị khử thành NO là 1; số phân tử HNO3 tạo muối Al(NO3)3 là 3

Đáp án A.
Ta có các quá trình :
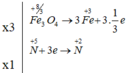
Số phân tử HNO3 đóng vai trò làm chất oxi hóa là 1
![]()
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.

8Al + 30HNO3 => 8Al(NO3)3 + 3N2O + 15H2O
=> tỉ lệ 4:1 (24 : 6)
=> Đáp án C

Đáp án B
Phương pháp : Cân bằng phương trình bằng phương pháp thăng bằng electron.
Hướng dẫn giải:
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O+ 15H2O
Số phân tử HNO3 môi trường = 24
Số phân tử HNO3 oxi hóa = 6
=> Tỉ lệ 4 :1
Đáp án D
Số phân tử bị khử chính bằng số phân tử N2O
8Al + 30HNO3 (loãng) → 8Al(NO3)3 + 3N2O + 15H2O