Dd HCl và dd CH3COOH có cùng nồng độ mol/1, pH của hai dd tương ứng là x và y. Quan hệ giữa x và y là (giả thiết, cứ 100 phân tử CH3COOH thì có 1 phân tử điện li)
A. y = x - 2
B. y = 2x
C. y = 100x
D. y = x + 2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2

Đáp án D
Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li
⇒ nH+/HCl = 100nH+/ CH3COOH
Mà dung dịch HCl và CH3COOH có cùng nồng độ
⇒ [H+/HCl] = 100[H+/ CH3COOH]
⇒ -log[H+/HCl] = -2 - log[H+/ CH3COOH]
⇒ x = -2 + y ⇒ y = x + 2
Đáp án D.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
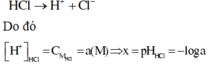
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
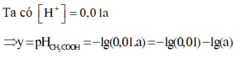
![]()
Đáp án A.

Chọn đáp án D
Đây là 2 dung dịch có môi trường bazo.NaOH có tính bazo mạnh hơn nên x >y.

Đáp án A
Bảo toàn điện tích:
n OH- = x = nNa+ - 2nSO42- = 0,07 – 0,02.2 = 0,03
n H+ = y = n ClO4- + n NO3- = 0,04 > n OH-
n H+ dư = 0,01 mol
⇒ [H+] = 0,01 : 0,1 = 0,1 ⇒ pH = -log10[H+] = 1
Đáp án D
Lấy mỗi axit nông độ là 0,1M
HCl H+ + Cl-
0,1 0,1 => pH = -1og(0,1) = 1=> x=1
CH3COOH ⥂ CH3COO- + H+
0,1 → 0,1/100 = 0,001
=> pH = -1og(0,001) = 3 => y=3
=> Đáp án D.