Cho dd KOH đến dư vào 200 ml dd NH4NO3 0,2M đun nóng nhẹ thấy thoát ra V lít khí (đktc) có mùi khai và dung dịch muối A a./ Viết PTHH ở dạng phân tử và ion rút gọn. b./ Tính giá trị V? c./ Cô cạn hết dung dịch muối A thì thu được muối khan. Tính khối lượng muối khan ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{BaCO_3}=\dfrac{1,97}{197}=0,01\left(mol\right);n_{HCl}=0,03\left(mol\right)\)
a)\(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
\(BaCO_3+2H^+\rightarrow Ba^{2+}+H_2O+CO_2\)
b)Lập tỉ lệ : \(\dfrac{0,01}{1}< \dfrac{0,03}{2}\) => HCl dư sau phản ứng
\(n_{CO_2}=n_{BaCO_3}=0,01\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,01.22,4=0,224\left(l\right)\)

Đáp án D
![]()
Khi cho từ từ HCl vào dung dịch X thì HCl sẽ phản ứng với theo thứ tự:
![]()
Khi đó ta có H+ hết. Khi đun nóng cô cạn dung dịch ta lại có phương trình:


2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
NH4+ + OH- → 2NH3↑ + H2O

Chọn A
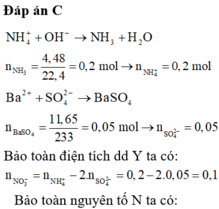
nOH- = 0,06x2 = 0,12 > nNH3 = 0,08 Þ OH- dư Þ Trong X có chứa nNH4+ = 0,08
BTĐT => n S O 4 2 - = (0,12 + 0,08 - 0,l)/2 = 0,05 < nBa2+ = 0,06 Þ Có 0,05 mol BaSO4 kết tủa
Þ Trong Z có nBa2+ = 0,06 - 0,05 = 0,01; nK+ = 0,12; nCl- = 0,1; nOH- = 0,12 - 0,08 = 0,04
Vậy m = 0,01x137 + 0,12x39 + 0,1x35,5 + 0,04x17 = 10,28.

a)PTHH:
2NaOH + (NH4)2SO4 ---> 2NH3 + 2H2O + Na2SO4
NH4(+) + OH(-) ---> NH3 + H2O
b/
0,15 mol (NH4)2SO4 tạo ra được 0,3 mol NH3
=> thể tích khí thu được là 6,72 lít

1 mol muối cacbonat chuyển thành 1 mol muối clorua tạo ra 1 mol CO 2 và khối lượng muối tăng : (M + 71) - ( M + 60) = 11g.
Theo đề bài, khối lượng muối tăng : 5,1 - 4 = 1,1 (g) sẽ có 0,1 mol CO 2 thoát ra.
Vậy V = 2,24 lít.