Đốt cháy chất hữu cơ X chỉ tạo ra CO2 và H2O. Đốt cháy hoàn toàn 9,2 gam X. Dẫn toàn bộ sản phẩm cháy vào 1 lít dung dịch Ca(OH)2 0,24M thu được 18 gam kết tủa và dung dich Y. Khối lượng dung dịch Y tăng so với khối lượng dung dịch Ca(OH)2 ban đầu là 2,4 gam. Đun nóng Y thu được thêm kết tủa. Công thức phân tử của X là:
A. C2H6O2
B. C3H8O3
C. C2H6O
D. C3H8O

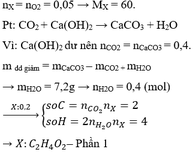
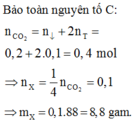
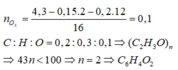
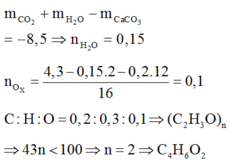
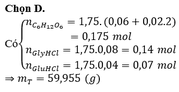


Đáp án B
nCaCO3 = 0,18 mol
nCa(OH)2 = 0,24 mol
BTNT “Ca” ta có: nCa(HCO3)2 = nCa(OH)2 – nCaCO3 = 0,24 – 0,18 = 0,06 mol
BTNT “C”: nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,18 + 2.0,06 = 0,3 mol => nC = 0,3 mol
Mặt khác, m dd tăng = mCO2 + mH2O – mCaCO3 => 2,4 = 0,3.44 + mH2O – 18
=> mH2O = 7,2 gam => nH2O = 0,4 mol => nH = 0,8 mol
mO(hchc) = mhchc – mC – mH = 9,2 – 0,3.12 – 0,8.1 = 4,8 gam => nO = 4,8 : 16 = 0,3 mol
C : H : O = 0,3 : 0,8 : 0,3 = 3 : 8 : 3
=> CTPT (C3H8O3)n hay C3nH8nO3n
Trong hchc ta luôn có: H ≤ 2C + 2 => 8n ≤ 2.3n + 2 => n ≤ 1
=> n = 1
Vậy CTPT của hchc là C3H8O3