Cho 3,78 gam bột nhôm phản ứng vừa đủ với dung dịch muối XCl3 tạo thành dung dịch Y, khối lượng chất tan trong dung dịch Y giảm 4,06 gam so với dung dịch XCl3. Xác định công thức của muối XCl3:
A. InCl3.
B. GaCl3
C. FeCl3.
D. CrCl3.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{3,78}{27}=0,14\left(mol\right)\\ Al+XCl_3\rightarrow AlCl_3+X\\ m_{giảm}=4,06\left(g\right)=m_X-m_{Al}\\n_X=n_{XCl_3}=n_{AlCl_3}=n_{Al}=0,14\left(mol\right)\\ m_X=m_{Al}+4,06=3,78+4,06=7,84\left(g\right)\\ M_X=\dfrac{7,84}{0,14}=56\left(\dfrac{g}{mol}\right)\\ Vậy.XCl_3.là:FeCl_3 \)

giải lại: Al + XCl3 => AlCl3 + X
khối lượng chất tan trong ddY giảm 4,04g so vs dd XCl3
=> mXCl3 - mAlCl3 = 4,04 (g)
<=> mX - mAl = 4,04
=> mX = 4,04 + 3,78 =7,82(g)
thep PTHH nXCl3 = nAl = 3,78/ 27 = 0,14 (g)
=> nX = nXCl3 = 0,14
=> M = 7,82 : 0,14 = 56 => FeCl3

C1: Al + XCl3 --> AlCl3 + X
nAl = 3,78 : 27 = 0,14 mol. => nAlCl3 tạo ra = 0,14 mol.
=> mAlCl3 = 0,14. 133,5 = 18,69g.
=> mXCl3 = 18,69 + 4,06 = 22,75g.
=> MXCl3 = 22,75 : 0,14 = 162,5 = X + 35,5 .3 => X = 56 (Fe)
C2: Dúng tăng giảm khối lượng
M chênh lệh giữa Al và X là 4,06 : 0,14 = 29 => x = 29 + 27 = 56 (fe)

Al+XCl3-->AlCl3+X
nAl=0,14mol
-->mXCl3=0,14.(X+106,5) g
mAlCl3=0,14.133,5=18,69g
mà khối lượng chất tan trong dd Y giảm 4.06g so với dung dịch XCl3
nên 0,14.(X+106,5)-18,69=4,06
\(\Rightarrow\)X=56
\(\Rightarrow\)FeCl\(_3\)

\(a,PTHH:2X+6HCl\to 2XCl_3+3H_2\\ b,n_{H_2}=\dfrac{6,72}{22,4}=0,3(mol)\\ \Rightarrow n_{X}=\dfrac{2}{3}n_{H_2}=0,2(mol)\\ \Rightarrow M_{X}=\dfrac{5,4}{0,2}=27(g/mol)\)
Vậy X là nhôm (Al)
\(c,n_{AlCl_3}=n_{Al}=0,2(mol)\\ \Rightarrow m_{AlCl_3}=0,2.133,5=26,7(g)\)

Đáp án A
Hai chất tan trong X là AgNO3 dư và HNO3 mới được tạo sau điện phân.
Theo đó, dung dịch ra Ag2O ứng với giảm 9,28 gam → số mol là 0,04 mol.
Từ lượng ra → đọc ngược lại có 0,08 mol HNO3 (tương quan 2H với 1O).
« Nhận xét:
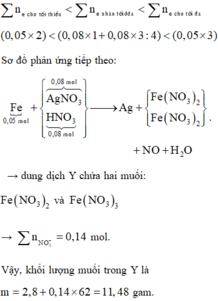
Đáp án C